Forskel mellem 1s og 2s Orbital | 1s vs 2s Orbital
Nøgleforskel - 1s vs 2s Orbital
Atom er den mindste enhed af materie. Med andre ord er alt stof lavet af atomer. Et atom består af subatomære partikler, primært protoner, elektroner og neutroner. Protoner og elektroner gør kernen, som er placeret i midten af atomet. Men elektroner er placeret i orbitaler (eller energiniveauer), der er placeret uden for kernen af et atom. Det er også vigtigt at bemærke, at orbitaler er hypotetiske begreber, der bruges til at forklare det mest sandsynlige sted for et atom. Der er forskellige orbitaler omkring kernen. Der er også sub-orbitaler som s, p, d, f osv. S-sub-orbitalen er kugleformet, når den betragtes som en 3D-struktur. S orbitalen har den højeste sandsynlighed for at finde en elektron omkring kernen. Et sub-orbital nummereres igen som 1s, 2s, 3s, etc. i henhold til energiniveauerne. Nøgleforskellen mellem 1s og 2s kredsløb er energien i hver kredsløb. 1s orbital har en lavere energi end 2'ers kredsløb.
INDHOLD
1. Oversigt og nøgleforskel
2. Hvad er 1s Orbital
3. Hvad er 2s Orbital
4. Side om side Sammenligning - 1s vs 2s Orbital
5. Sammendrag
Hvad er 1s Orbital?
1s orbital er orbitalet, som er tættest på kernen. Den har den laveste energi blandt andre orbitaler. Det er også den mindste sfæriske form. Derfor er radiusen af s orbitale lille. Der kan kun være 2 elektroner i s orbitale. Elektronkonfigurationen kan skrives som 1s 1 , hvis der kun er én elektron i s-orbitalen. Men hvis der er et par elektroner, kan det skrives som 1s 2 . Derefter bevæger de to elektroner i s-kredsløbene mod de modsatte retninger på grund af den afstødning, der opstår på grund af de samme elektriske ladninger af de to elektroner. Når der er en opparet elektron, kaldes den paramagnetisk. Det skyldes, at det kan tiltrækkes af en magnet. Men hvis orbitalet er fyldt og et par elektroner er til stede, kan elektronerne ikke tiltrækkes af en magnet; dette er kendt som diamagnetic.
Hvad er 2s Orbital?
2'ers kredsløb er større end 1s omløbet. Derfor er dens radius større end den for 1'ers kredsløb. Det er det næste skab skiftet til kernen efter 1s omløbet. Dens energi er højere end 1s omløbet, men er lavere end andre orbitaler i et atom. 2s kredsløb kan også kun fyldes med en eller to elektroner. Men 2s kredsløb er kun fyldt med elektroner efter afslutningen af 1s omløbet.Dette kaldes Aufbau-princippet, hvilket angiver rækkefølgen af elektronfyldning i sub-orbitaler.
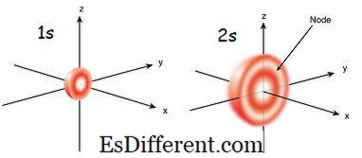
Figur 01: 1s og 2s Orbital
Hvad er forskellen mellem 1s og 2s Orbital?
- diff Artikel Mellem før tabel ->
1s vs 2s Orbital |
|
| 1s orbital er den nærmeste kredsløb til kernen. | 2s orbital er den næst nærmeste kredsløb til kernen. |
| Energiniveau | |
| Energi af 1s-kredsløb er højere end for 2s-kredsløb. | 2s har forholdsvis lavere energi. |
| Radius af kredsløb | |
| Radius af 1s kredsløb er mindre. | Radien af 2'ers kredsløb er forholdsvis stor. |
| Orbitalstørrelse | |
| 1s bane har den mindste sfæriske form. | 2s orbital er større end 1s omløbet. |
| Elektronfyldning | |
| Elektroner fyldes først i 1s-omgangen. | 2s kredsløb er kun fyldt efter færdiggørelsen af elektroner i 1s-kredsløbet. |
Sammenfatning - 1s vs 2s Orbital
Et atom er en 3D-struktur, der indeholder en kernen i midten omgivet af forskellige formede orbitaler af forskellige energiniveauer. Disse orbitaler er igen opdelt i sub-orbitaler i henhold til små energiforskrifter. Elektroner, som er en større subatomic partikel af et atom, er placeret i disse energiniveauer. 1s og 2s sub-orbitaler er nærmest kernen. Hovedforskellen mellem 1s og 2s orbitals er forskellen på deres energiniveau, hvilket er 2s orbital er et højere energiniveau end 1s orbital.
Reference:
1. Libretexts. "Atomiske Orbitaler. "Chemistry LibreTexts. Libretexts, 03 Nov. 2015. Web. 26. maj 2017..
2. Atomer, Elektroner og Orbitaler. N. p., n. d. Web. 26. maj 2017..
Image Courtesy:
1. "S orbitals" (beskåret) Af CK-12 Foundation - Fil: High School Chemistry. pdf, side 265 (CC BY-SA 3. 0) via Commons Wikimedia




