Forskel mellem acetaldehyd og acetone | Acetaldehyd vs Acetone
Nøgleforskel - Acetaldehyd vs Acetone
Både Acetaldehyd og Aceton er små organiske molekyler, men der er forskel på dem baseret på deres funktionelle grupper. Med andre ord er de to forskellige carbonylforbindelser med forskellige kemiske og fysiske egenskaber. Aceton er det mindste medlem af ketongruppen, mens acetaldehyd er det mindste medlem af aldehydgruppen. nøgleforskellen mellem acetaldehyd og aceton er antal carbonatomer i strukturen; acetone har tre carbonatomer , men acetaldehyd har kun to carbonatomer. Forskellen i antallet af carbonatomer og med to forskellige funktionelle grupper fører til mange andre forskelle i deres egenskaber.
Hvad er aceton?
Aceton er det mindste medlem af ketongruppen, også kendt som propanon . Det er en farveløs, flygtig, brændbar væske, der anvendes som opløsningsmiddel. De fleste af de organiske opløsningsmidler opløses ikke i vand, men aceton er blandbar med vand. Det bruges meget ofte til rengøringsformål i laboratoriet og som den vigtigste aktive ingrediens i neglelakfjernervæsker og i maling tyndere.

Hvad er acetaldehyd?
Acetaldehyd, også kendt som etanal , er det mindste medlem af aldehydgruppen. Det er en farveløs, brandfarlig væske med en stærk kvælende lugt. Der er mange industrielle anvendelser såsom fremstilling af eddikesyre, parfume, stoffer og nogle smagsstoffer.
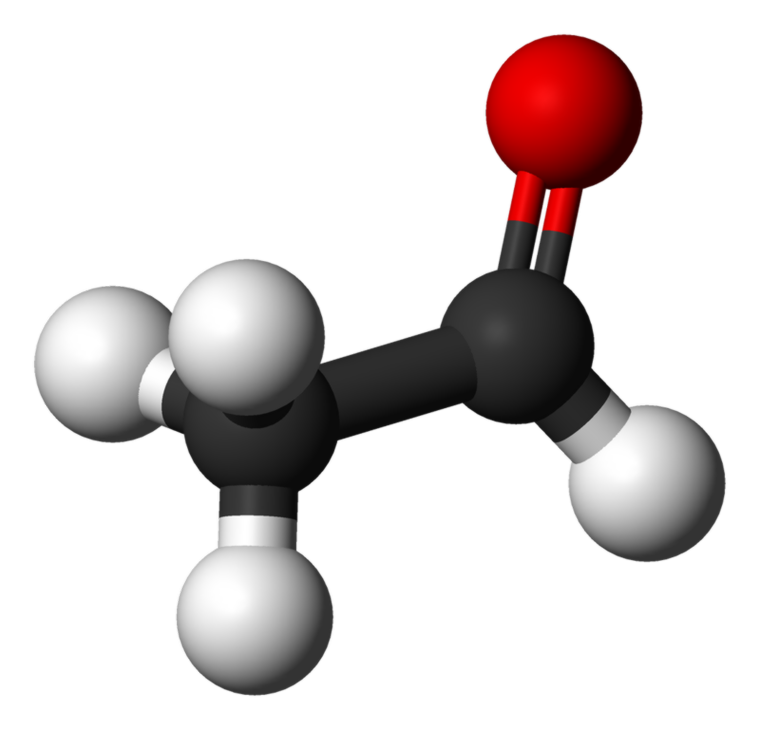
Hvad er forskellen mellem acetaldehyd og acetone?
Struktur og generelle egenskaber af acetaldehyd og aceton
Aceton: Molekylformlen af acetone C 3 H 6 O. Det er det enkleste medlem af ketonfamilien. Det er en flygtig, brændbar væske med en skarp lugt.

Acetaldehyd: Molekylformlen af acetaldehyd C 2 H 4 O. Det er den enkleste og en af de vigtigste medlemmer af aldehydfamilien. Det er en farveløs, flygtig, brændbar væske ved stuetemperatur.

Forekomst af acetaldehyd og aceton
Aceton: Generelt er aceton til stede i humant blod og urin. Det er også genereret og afsat i den menneskelige krop under den normale metabolisme. Når mennesker har diabetikere, produceres det i større mængder i menneskekroppen.
Acetaldehyd: Acetaldehyd findes naturligt i forskellige planter (kaffe), brød, grøntsager og modne frugter.Derudover findes den i cigaretrøg, benzin og dieseludstødning. Det er også et middel i alkoholens metabolisme.
Anvendelse af acetaldehyd og acetone
Aceton: Aceton anvendes hovedsagelig som et organisk opløsningsmiddel i de kemiske laboratorier og er også det aktive middel til fremstilling af neglelakfjerner og tyndere i malingsindustrien.
Acetaldehyd: Aceton anvendes til fremstilling af eddikesyre, parfumer, farvestoffer, smagsstoffer og lægemidler.
Karakteristik af acetaldehyd og aceton
Identifikation
Aceton: Aceton giver et positivt resultat for iodoform test. Derfor kan det let differentieres fra acetaldehyd ved anvendelse af iodoform test.
Acetaldehyd: Acetaldehyd giver et sølvspejl til "Tollen's reagens", mens ketoner ikke giver et positivt resultat for denne test. Fordi det ikke kan oxideres let. Chronsyre-test og Fehlings reagens kan også bruges til at identificere acetaldehyd.
Reaktivitet
Karbonylgruppernes reaktivitet (aldehyder og ketoner) skyldes hovedsageligt carbonyl (C = O) -gruppen.
Aceton: Generelt er alkylgrupper elektrondonerende grupper. Aceton har to methylgrupper og reducerer polariseringen af carbonylgruppen. Derfor gør det forbindelsen mindre reaktivt. To methylgrupper, der er fastgjort til begge sider af carbonylgruppen, medfører også en større stearisk hindring. Derfor er acetone mindre reaktivt end acetaldehyd.
Acetaldehyd: Acetaldehyd har derimod kun én methylgruppe og et hydrogenatom bundet til carbonylgruppen. Som methylgruppe donerer elektroner trækker hydrogenatom elektroner; Dette gør molekylet mere polariseret, og det gør molekylet mere reaktivt. Sammenlignet med acetone har acetaldehyd mindre steariske virkninger, og andre molekyler kan nærme sig let. På grund af disse årsager er acetaldehyd mere reaktivt end acetone.




