Forskel mellem hårdt vand og tungt vand | Hårdt vand vs tungt vand
Nøgleforskel - hårdt vand mod tungt vand
Nøgleforskellen mellem hårdt vand og tungt vand er deres sammensætning, da både typer, "hårdt vand" og "tungt vand" refererer til vandet med to hydrogenatomer og et oxygenatom i vandmolekylet. Når vi overvejer molekylær sammensætning af tungt vand , indeholder det mere deuteriumatomer end hydrogenatomer. Den molekylære sammensætning af hårdt vand er det samme som det normale vand, men dets mineralsammensætning (Magnesium-Mg og Calcium-Ca) er relativt højere end blødt vand.
Hvad er tungt vand?
Et vandmolekyle indeholder to hydrogenatomer og et oxygenatom. Hydrogen har tre isotoper; protium (99,98%), deuterium og tritium. Protium har en elektron og en neutron. Deuterium har en neutron i kernen ud over elektronen og protonen. Deuterium er dobbelt så tungere end det mest almindelige hydrogenatom.
Tungt vand indeholder en stor del af deuteriumatomer end det sædvanlige hydrogenatom. Derfor er dens molekylvægt og densiteten højere end det normale vand. Det siges, at tætheden af tungt vand er 11 gange større end normalt vand.
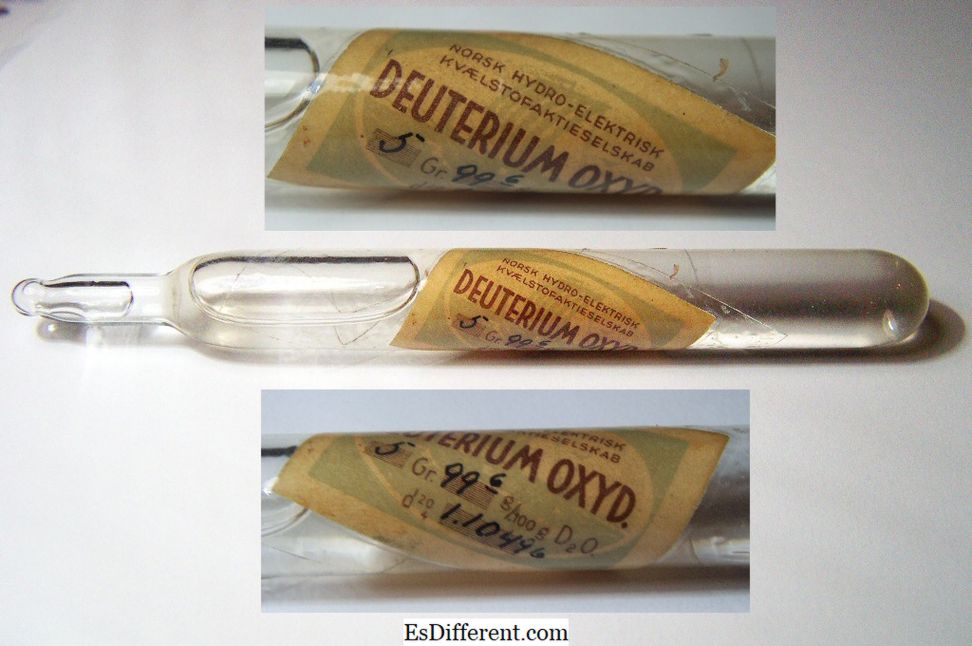
En historisk prøve af "tungt vand", pakket i en forseglet kapsel.
Hvad er hårdt vand?
Vand indeholder generelt en del mineraler som magnesium, calcium og kalium. Men hårdt vand indeholder flere mineraler, især Magnesium (Mg) og Calcium (Ca) end normalt vand (blødt vand). På grund af dette er hardheden af det hårde vand større end hårdheden af det normale vand. Dette sker, når overfladevand strømmer gennem jorden i grundvandslaget ved at opløse mineralerne i det fritflydende vand.
Hårdt vand giver ingen skadelig virkning på menneskers sundhed, men det forårsager så mange ekstra problemer som at efterlade hvide farvede forekomster i madlavning eller kogende udstyr, badeværelsesgulve og i vandrør.

Hvad er forskellen mellem hårdt vand og tungt vand?
Definition af hårdt vand og tungt vand
Tungt vand: Hårdt vand er vand, der indeholder en væsentlig del af deuteriumatomer, der anvendes i atomreaktorer
Hårdt vand: Hårdt vand er vand, der indeholder en mærkbar mængde af opløste salte af calcium og magnesium.
Egenskaber for hårdt vand og tungt vand
Sammensætning
Tungt vand: Tungt vand indeholder en stor del af deuterium (indeholder en ekstra neutron i atomkraft) atomer end det normale vand.Den indeholder både hydrogenatomer og deuteriumatomer, der danner vandmolekylerne med molekylformlen som D 2 O (Deuterium Oxid) og HDO (Hydrogen-Deuterium Oxid).
Hårdt vand: På molekylærniveau svarer sammensætningen af hårdt vand til det normale vand (H 2 O). Men det indeholder flere mineraler; Magnesium og Calcium end det normale drikkevand.
Fysiske og kemiske egenskaber
Tungt vand: Fysisk og kemisk egenskaber af tungt vand svarer til det normale vand, men det har en højdensitetsværdi. Molekylvægten af det tunge vand viser ikke en signifikant ændring, fordi det enkelte oxygenatom bidrager med ca. 89% til molekylvægten. Biologiske egenskaber ved tungt vand er forskellige fra det normale vand.
Hårdt vand: Hårdhed er hovedegenskaben, der er væsentligt forskellig fra normalt vand.
USGS-klassificering af vandhårdhed
- diff Artikel Mellem før bord ->| Hårdhed / mgl -1 | Vandets natur |
| 0-60 | Blødt vand |
| 61-120 | Moderat hårdt vand |
| 121- 180 | Hårdt vand |
| <180 | Meget hårdt vand |
Den anbefalede grænseværdi for hårdhed i drikkevand er 80-100 mgl -1
Sundhedseffekt < Tungt vand:
En del mængde deuterium er til stede i menneskekroppen, men en stor del af deuterium forårsager skadelige helbredseffekter i menneskekroppen, det kan endda forårsage døden. Hårdt vand giver ingen sundhedsmæssige virkninger i menneskekroppen, men det forårsager andre problemer som f.eks. At blokere vandrør og efterlade mineralforekomster på varmeapparater, køkkenudstyr og badeværelsesgulve. For at overvinde disse problemer forårsaget af det hårde vand fjernes mineralerne. Dette kaldes blødgøring. Den mest anvendte effektive metode er ionbytterharpiksen som blødgøringsmiddel. Image Courtesy:
"Dripping Kran 1" af Bruger: Dschwen - eget arbejde. (CC BY-SA 2. 5) via Wikimedia Commons "Deuterium oxide Norsk" af Alchemist-hp (talk) (www. Pse-mendelejew. De) - eget arbejde. (FAL) via Commons




