Forskel mellem isotonisk og hypertonisk | Isotonisk vs Hypertonisk
Hovedforskel - Isotonisk vs Hypertonisk
Det er vigtigt at forstå begrebet Tonicity før analysere forskellen mellem isotonisk og hypertonisk. Lad os derfor først kort beskrive begrebet tonicitet og dets betydning. Tonicitet er variansen i vandkoncentration af to opløsninger divideret med en semipermeabel membran. Det kan også forklares som den relative vandkoncentration af opløsninger, der bestemmer retningen og mængden af diffusion af vand, indtil den opnår lige koncentrationer på begge sider af membranen. Ved at identificere toniciteten af løsninger, kan vi bestemme i hvilken retning vand vil diffunde. Dette fænomen er almindeligt anvendt, når man illustrerer responsen af celler nedsænket i en ekstern løsning. Der er tre klassifikationer af tonicitet, som en løsning kan have i forhold til en anden. De er hypertoniske, hypotoniske og isotoniske. nøgleforskellen mellem isotonisk og hypertonisk er, at den hypertoniske opløsning indeholder mere opløsningsmiddel end opløst mens opløsningsmidlet og opløsningsmidlet fordeles ligeligt i den isotoniske opløsning. Imidlertid er det ikke vigtigt at huske definitionen af hypertoniske og isotoniske opløsninger, hvis vi kan forstå forskellen mellem isotoniske og hypertoniske løsninger.
Hvad er Hypertonic?
Hyper er et andet ord for over eller overdreven. Hypertoniske opløsninger vil have en højere koncentration af opløst stof (glucose eller salt) end cellen. Opløsninger er de elementer, der opløses i et opløsningsmiddel, hvorved der dannes en opløsning. I en hypertonisk opløsning er koncentrationen af opløste stoffer større uden for cellen end inde i den. Når en celle er nedsænket i en hypertonisk opløsning, vil der være et osmotisk skift, og vandmolekyler vil strømme ud af cellen for at balancere koncentrationen af opløste stoffer, og der vil være krympning i cellens størrelse.
Hvad er isotonisk?
Iso er et andet ord for lige og tonic er for tonicity af løsningen. Isotoniske opløsninger vil have en tilsvarende koncentration af opløst stof end den løsning, den sammenlignes med. I en isotonisk opløsning er koncentrationen af opløste stoffer det samme både indenfor og uden for cellen, hvilket skaber en ligevægt inden for den cellulære organisations miljø. Når en celle er nedsænket i en isotonisk opløsning, vil der ikke være et osmotisk skift, og vandmolekylerne diffunderer gennem cellemembranen i begge retninger for at afbalancere koncentrationen af opløste stoffer.Denne proces vil ikke skabe hævelse eller krympning af cellen.

Hvad er forskellen mellem isotonisk og hypertonisk?
Forskellene mellem hypertonisk og isotonisk kan klassificeres i følgende kategorier.
Definition af Isotonisk og Hypertonisk
Hypertonisk: "hyper" er kendt som ovenfor eller overdreven + "tonic" er kendt som noget i lighed med en løsning. Således antyder hypertonisk øget tonicitet af opløsningen.
Isotonisk: "iso" er kendt som samme + "tonic" er kendt som noget i lighed med en løsning. Isotonisk foreslår således lignende tonicitet af opløsningen.
Karakteristik af Isotonisk og Hypertonisk
Koncentration af opløst stof og opløsning
Hypertonisk: Løsningen indeholder mere opløsningsmiddel end opløst stof.
Isotonisk: Opløsningsmiddel og opløsningsmiddel i opløsningen fordeles på lige fod.
Eksempler
Hypertonisk: Renset vand, fordi ingen / mindre opløste opløses i det rensede vand, og dets koncentration er meget lav sammenlignet med det cellulære miljø.
Isotonisk: Salinopløsning er en isotonisk til humant blodplasma
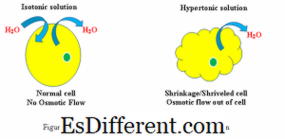
Cellerespons i hypertonisk og isotonisk opløsning (Se figur 1)
Hypertonisk: Når en biologisk celle er i en hypertonisk miljø, strømmer vand over cellemembranen ud af cellen for at balancere koncentrationen af opløste stoffer i både cellen og omgivelserne omkring cellen. Som følge heraf vil -cellen krympe som vand forlader cellen for at reducere den højere koncentration af opløst stof i det ydre miljø.
Isotonisk: Når en celle er i en isotonisk opløsning, vil den ikke skabe hævelse eller krympning af cellen.
Vandkoncentrationsgradient
Hypertonisk: Vandkoncentrationsgradient kan observeres fra indersiden af cellen til den hypertoniske opløsning
Isotonisk: Vandkoncentrationsgradient eksisterer ikke
Solut koncentrationsgradient < Hypertonisk:
Solut koncentrationsgradient ses fra den hypertoniske opløsning til indersiden af cellen Isotonisk:
Solut koncentrationsgradient eksisterer ikke. Osmotisk skift
Hypertonisk:
osmotisk skift eksisterer. Isotonisk:
Osmotisk skift eksisterer ikke Bevægelse af vand
Hypertonisk:
Vandmolekyler flytter eller diffunderer hurtigt fra indersiden af cellen til ydre opløsningsretninger, og således vil cellen tabe vand. Isotonisk:
Vandmolekyler bevæger sig eller diffunderer i begge retninger, og mængden af vanddiffusion er ens i hver retning. Celle vil således enten opnå eller tabe vand. Sportsdrikke
Isotonisk:
En isotonisk drik omfatter tilsvarende koncentrationer af salt, sukkercarbohydrat og elektrolytter som i menneskekroppen. Isotonisk sportsdrik er ofte foretrukket som en oral rehydrering løsning. Det har normalt 4-8 g kulhydrat pr. 100 ml. Hypertonisk:
Hypertonisk drik omfatter højere koncentrationer af salt, sukkercarbohydrat og elektrolytter som i den menneskelige krop.Det har normalt ca. 8 g kulhydrat pr. 100 ml. En hypertonisk opløsning anvendes også i osmoterapi for at klare cerebral blødning. Hypertoniske sportsdrinks er ideelle til dem, der har brug for meget høje niveauer af energi. Som konklusion er der tre former for løsninger, der er baseret på opløst koncentration, og de er isotoniske, hypotoniske og hypertoniske. Koncentrationen af opløste stoffer er den samme både indenfor og uden for cellen i en isotonisk opløsning. Koncentrationen af opløste stoffer er større inden i cellen end det ydre miljø i en hypotonisk opløsning, mens den hypertoniske opløsning er en, hvor koncentrationen af opløste stoffer er større udenfor miljøet end inden i cellen.
Referencer Mansoor, M. A., Beverly, J. og Sandmann. (2002). Anvendt fysisk apotek. McGraw-Hill Professional. s. 54-57. Voet, D., Judith, G. V. og Charlotte, W. P. (2001). Fundamentals of Biochemistry (Rev. ed.). New York: Wiley. s. 30. Image Courtesy: "Osmotisk tryk på blodceller diagram" af LadyofHats - gjorde det selv baseret på [1], [2], [3] og [4] … (Public Domain) via Wikimedia Commons




