Forskel mellem nitrat og nitrit
Nitrat vs Nitrit
Både nitrat og nitrit er oxyanioner af nitrogen. Selvom de begge ser ud til at ligne ens, er der forskelle mellem dem. Disse forskelle kan være med hensyn til deres struktur, binding, geometrisk form, oxidationstilstand for kvælstof, kemisk reaktivitet, anvendelser af dem og osv. Disse forskelle diskuteres hovedsagelig her.
NEJ 3 - ion er den konjugerede base af HNO 3 (salpetersyre V syre), som er en stærk syre. Det er et plantemolekyle med sp 3 hybridisering i nitrogenatomer. Alle tre oxygenatomer er ækvivalente. Der er 24 elektroner i valensskallerne. NEJ 3 - ion har en molekylvægt på 62. 004 g mol -1 .
NEJ 2 - ion er den konjugerede base af HNO 2 (salpetersyre III), som er en svag syre (pKa = 3, 5). Det er også et plantemolekyle med sp 2 hybridisering. I valensskallerne er der kun 18 elektroner. NEJ 2 - ion har en molekylvægt på 46,006 g mol -1 .
Når bindingen i begge ioner overvejes, i NO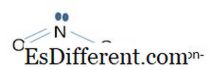

3 - ion, involverer pi-bindingen fire 2p z atomorbitaler (en orbitla fra N og tre orbitaler fra 3 oxygenatomer). Disse fire atomiske orbitaler danner 4, fire-centrerede pi molekylære orbitaler. Den molekylære kredsløb med den laveste energi er bindingsbanen. Orbitalet med den største energi er det anti-bindende orbitale. Andre to orbitaler er degenereret (lig med energi), som er ikke-bindende orbitaler. I tilfælde af NO 2 - ion involverer pi-bindingen kun tre 2p z atomorbitaler. Her er orbitalet med den laveste energi bindingsbanen, den midterste er den ikke-bindende kredsløb, og den anden er det anti-bindende kredsløb. I begge ioner involverer bindingsorbitalerne i at gøre σ-bindingen (sigma-bindingen) og ikke-bindende orbitaler involverer i fremstilling af π-bindinger (pi-bindinger). Derfor har hver binding i NO 3 - ion en bindingsrækkefølge på 1 1 / 3 . 1 fra σ-binding og 1 / 3 fra π-bindingerne. I NO 2 - ion er bindingsrækkefølgen 1 1 / 2 . 1 fra σ-binding og 1 / 2 fra π-bindingerne.
3 - ion har en form som planerstriangulær og NO 2 - ion har en vinkelform (eller V form). Obligationsvinklerne er også forskellige. ONO bindingsvinkel på NO 3 - ion og NO 2 - ion er henholdsvis 120 0 og 115 0 . Oxidationstilstanden for nitrogen i både NO 3 - ion og NO 2 - ion er henholdsvis +5 og +3.På grund af disse grunde (især forskellen i binding) er den kemiske reaktivitet (såsom basicitet, oxiderende / reducerende evne, produkter med termisk nedbrydning af forbindelserne af disse ioner) også forskellig. I praksis er NEJ
2 - ion en svagere base, mens NO 3 - ion er en meget svagere base. Når oxidationstilstanden af nitrogenatomer i disse ioner tages i betragtning, kan NEJ 2 - ion virke som et reduktionsmiddel såvel som et oxidationsmiddel, mens NO 3 - ion kan kun fungere som et oxidationsmiddel. Eksemplerne på produkter opnået ved termisk dekomponering af NO

3 - og NO 2 - ioner indeholdende forbindelser er angivet nedenfor for at vise forskellen i reaktivitet. Selv når de danner komplekser med metalioner, opfører de sig på en anden måde. Det vil sige, at ingen

2 - ion virker som en monodentatligand, mens ingen 3 - ion virker som en bidentatligand. Disse forskelle i kemisk reaktivitet hjælper os med at differentiere brugen af dem. For eksempel anvendes nitrit generelt til forarbejdning af kød (til tider anvendes også nitrater), og nitrater anvendes til fremstilling af sprængstoffer. Nitre er naturligt forekommende og er kræftfremkaldende. Men nitritter er ikke kræftfremkaldende.