Forskel mellem normal hæmoglobin og sylcellehemoglobin | Normal Hæmoglobin vs Sickle Cell Hæmoglobin
Nøgleforskel - Normal hæmoglobin vs Sickle-hæmoglobin
Hemoglobin (Hgb) er det vigtigste proteinmolekyle, der giver Den røde blodcelles typiske form - rund form med et smalt center. Hemoglobinmolekylet består af fire subproteinmolekyler, hvor to kæder er alfa-globulinkæder, og de to andre er beta-globulinkæder. Jernatomer i hæmoglobin og formen af de røde blodlegemer er vigtige for oxygentransport gennem blod. Hvis formen af hæmoglobin ødelægges, formår den ikke at transportere ilt gennem blodet. Sicklecelle hæmoglobin er en type af et unormalt hæmoglobinmolekyle, der forårsager en anæmi-tilstand, der kaldes sigcelleanæmi. Hovedforskellen mellem normalt hæmoglobin og hæmcellehemoglobin er, at normalt hæmoglobin har glutaminsyre i positionen 6 th af aminosyresekvensen af beta-globulinkæden mens seglcelle hæmoglobin har Valine i positionen 6 th af beta-globulinkæden. Normal hæmoglobin og sigtecelle hæmoglobin varierer kun med en enkelt aminosyre i beta kæder.
INDHOLD
1. Oversigt og nøgleforskel
2. Hvad er normalt hæmoglobin
3. Hvad er Sickle Cell Hemoglobin
4. Side om side sammenligning - Normal hæmoglobin vs Sickle Cell hæmoglobin
5. Sammendrag
Hvad er normalt hæmoglobin?
Hemoglobin er et jernholdigt metalloprotein, der findes i røde blodlegemer. Det er ansvarligt for transport af ilt fra lungen til kroppens væv og organer og transport af kuldioxid fra kropsvæv til lungen. Det er også kendt som iltbærende protein i blodet. Det er et komplekst protein, der består af fire små proteinunderenheder og fire hæmegrupper, der bærer jernatomer som vist i figur 01. Hæmoglobin har en høj affinitet for ilt. Der er fire oxygenbindingssteder placeret inde i et hæmoglobinmolekyle. Når hæmoglobin er mættet med ilt, bliver blodet rødt rødt og er kendt som oxygeneret blod. Den anden tilstand af hæmoglobinet, der mangler ilt, er kendt som deoxyhemoglobin. I denne tilstand har blod den mørkerøde farve.
Jernatomer indlejret i hæmforbindelsen af hæmoglobin letter hovedsageligt ilt- og kuldioxidtransporten.Binding af iltmolekyler til Fe +2 ioner ændrer hæmoglobinmolekylets konformation. Jernatomerne i hæmoglobinet hjælper også med at opretholde den typiske form af den røde blodlegeme. Derfor er jern et vigtigt element, der findes i de røde blodlegemer.
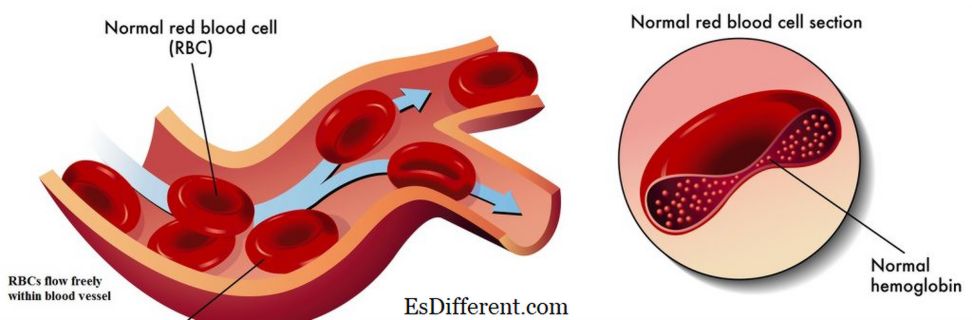
Figur 01: Normal hæmoglobin
Hvad er Sickle Cell Hemoglobin?
Syklecelleanæmi er en blodtilstand forårsaget af unormale hæmoglobinproteiner, der findes i de røde blodlegemer. Sicklecelle hæmoglobin er en type af abnormt hæmoglobin fundet i røde blodlegemer. De er også kendt som hæmoglobin S. De besidder segl eller halvmåneformer. De produceres som et resultat af sigtecellegenmutation. Denne mutation ændrer en enkelt aminosyre i aminosyresekvensen af normal hæmoglobin-beta-kædepeptid. Sicklecelle hæmoglobin er også sammensat af to alpha og to beta subunits, ligesom normalt hæmoglobin. Der er imidlertid en enkelt aminosyreforskel i beta-underenheder på grund af mutationen. I normal hæmoglobin er 6 th stillingen af aminosyrekæden i beta kæder sammensat af glutaminsyre. I hæmcellehæmoglobin er positionen 6 th imidlertid optaget af en anden aminosyre kaldet valin. Selv om det er en enkelt aminosyre forskel, er det årsagen til livstruende anæmi sygdom kaldet seglcelle sygdom.
Når valin er placeret til 6 th , forårsager betakæden at danne et fremspring, som passer til betagekæder af andre hæmoglobinmolekyler. Disse forbindelser gør hæftcellehemoglobin til at aggregere hinanden uden at forblive i opløsningen og transportere ilt. Det tager en stiv struktur, og til sidst nedbryder røde blodlegemer for tidligt, hvilket fører til anæmibetingelser.

Figur 02: Sickle Cell Hemoglobin
Hvad er forskellen mellem normal hæmoglobin og Sickle Cell hæmoglobin?
- diff Artikel Mellem Mellem før Tabel ->
Normal Hemoglobin vs Sickle Cell Hemoglobin |
|
| Normalt hæmoglobin er et jernholdigt protein i de røde blodlegemer, som transporterer ilt og kuldioxid gennem blodet. | Hæmcellehemoglobin er en type unormal hæmoglobin, der forårsager agglutinering af seglformede røde blodlegemer i blodet. |
| Forkortelse | |
| Forkortelse af det normale hæmoglobin er HbA . | Forkortelse af hæmcellehemoglobin er HbS . |
| Struktur | |
| Strukturen af normalt hæmoglobin består af to alfa kæder og to betakæder. | Struktur af seglcellehemoglobin består af to alfa kæder og to S-kæder. |
| Form | |
| Normal hæmoglobin er rund med et smalt center. | Formen af den røde blodlegeme indeholdende seglcellehæmoglobin er halvmåne eller seglform. |
| 6th Position af Aminosyre | |
| Den sjette position i aminosyrekæden af beta-globulinkæden er glutaminsyre. | Den sjette position er optaget af valin i seglcellehemoglobiner. |
| Resultat | |
| Normal hæmoglobin forårsager, at røde blodlegemer strømmer frit i blodkar. | Hæmcellehemoglobin forårsager blokering af strømmen af røde blodlegemer i karrene. |
Sammendrag - Normal hæmoglobin vs Sickle Cell hæmoglobin
Hæmoglobin er det oxygentransporterende protein i røde blodlegemer. Den består af fire underenheder af proteiner, der hedder alpha- og beta-kæder. Det er et jernholdigt molekyle, der forårsager farven og den runde form af de røde blodlegemer. På grund af mutationer kan formen på de røde blodlegemer afvige. Det sker på grund af unormale hæmoglobinmolekyler i de røde blodlegemer. Sicklecelle hæmoglobin er en sådan mutation. De ændrer formen af de røde blodlegemer fra runde til sekelform, hvilket i sidste ende fører til for tidlige ødelæggelser af røde blodlegemer. Denne sygdomstilstand er kendt som seglcelleanæmi. Forskellen mellem normal hæmoglobin og seglcellehæmoglobin er imidlertid en enkelt aminosyreforskel i beta-kæden i hæmoglobinet.
Reference:
1. Molecular Biology of Sickle Cell Anemia. N. p., n. d. Web. 28. maj 2017..
2. "Sickle celle sygdom - Genetics Home Reference. "U. S. National Library of Medicine. National Institutes of Health, n. d. Web. 28. maj 2017.
Image Courtesy:
1. "Risk-Factors-for-Sickle-Cell-Anemia (1) 2" Af Diana Grib - Egentligt arbejde (CC BY-SA 4. 0) via Commons Wikimedia [Beskåret]


