Forskel mellem syre-base titrering og redox titrering | Acid-Base Titration vs Redox Titration
Nøgleforskel - Acidbase Titration vs Redox Titration
Generelt, Titreringer anvendes til bestemmelse af koncentrationen af en ukendt opløsning (analyt). De mest anvendte to titrimetriske metoder er syre-base titreringer og redox titreringer. nøgleforskellen mellem syre-base titreringer og redox titreringer er karakteren af den reaktion, der sker mellem titranten og analytten i titrering. Ved syrebasetitreringer finder en neutraliseringsreaktion sted, og i redoxtitreringer finder en redoxreaktion sted (en oxidationsreaktion og en reduktionsreaktion). Anvendelsen af indikatorer er den mest almindeligt anvendte metode til bestemmelse af reaktionens endepunkt.
Hvad er en sur-base-titrering?
Ved syre-base titreringer anvendes en syre (sure titreringer) eller en base (basiske titreringer) som titranten. Eksempler på syrer anvendt i sure titreringer er H 2 SO 4 , HCI eller HNO 3. Mest anvendte basiske titranter er NaOH, K 2 CO 3 eller Na 2 CO 3. Syre-base titreringer kan klassificeres som følger afhængigt af styrken af syren og basen.
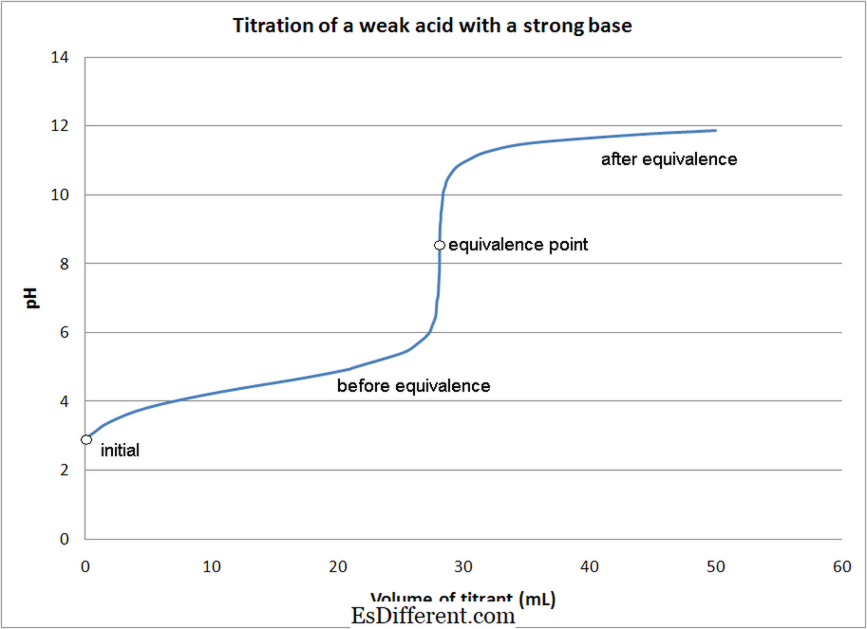
Stærk syre - stærke basetitreringer- stærke syre-svage basetitreringer
- svag syre - stærke basetitreringer
- svag syre - svage basetitreringer
- i de fleste syre -baserede titreringer, anvendes indikatorer til bestemmelse af reaktionens slutpunkt. Forskellige indikatorer anvendes, afhængigt af typen af titrering som nævnt ovenfor.
En redox titrering indebærer en redox reaktion. Redox reaktion har to reaktioner; en oxidationsreaktion og en reduktionsreaktion. Både oxidations- og reduktionsprocesser finder sted samtidig, hvor vi tillader at bestemme afslutningen af reaktionen. Dette kaldes også titreringens slutpunkt. Dette kan bestemmes på flere måder; ved hjælp af indikatorelektroder, redoxindikatorer (indikatoren giver en anden farve ved oxidationsreduktionstilstand) og indikatorer for ikke-redox (indikator frembringer en farve, når der tilsættes et overskud af titrant).
Hvad er forskellen mellem Acid-Base Titration og Redox Titration?

Reaktionens art:
Syre-base titrering:
En syre-base titrering involverer en neutraliseringsreaktion mellem analytten (opløsningen med den ukendte koncentration) og den sure eller basiske titrant. Redox Titration:
En redox reaktion indebærer en oxidations- og reduktionsreaktion mellem analytten og titranten. Der er ingen sådan regel, at komponent oxiderer og hvilken som reducerer. Enten analytten eller titranten oxiderer, og den resterende komponent reduceres tilsvarende. Bestemmelse af slutpunktet:
Syrebase-titrering:
Generelt anvendes en pH-indikator, en pH-måler eller en konduktansmåler til bestemmelse af slutpunktet for en syre-base titrering. Redox Titration:
De mest almindeligt anvendte metoder til bestemmelse af slutpunktet af en redox-reaktion bruger et potentiometer eller en redoxindikator. Men oftest producerer analytten eller titranten en farve ved endepunktet. Derfor er der ikke behov for yderligere indikatorer i disse tilfælde. Eksempler:
Syre-base-titrering:
- diff Artikel Mellem før tabel ->
Type| Reaktion (Indikator) | Sterk syre - stærk basetitrering |
| HCI + NaOHàNaCl + H | 2 O (Phenolphthalein / Methyl orange) Stærk syre - svag basetitrering |
| HCl + NH | 3 à NH 3 Cl (Methyl orange) Svag syre - stærk basetitrering |
| CH | 3 COOH + NaOHà CH 3 COONa + H 2 O (Phenolphthalein) Svag syre-svag base titrering CH |
| 3 | COOH + NH 3 ACH 3 COO - + NH 4 + Redox titrering: 2 KMnO 4 |
+ 5 H
2 C 2 O 4 + 6 HCI → 2 MnCl 2 + 2KCl + 10 CO 2 + 8 H 2 O (+7) (+3) (+2) 4) I ovennævnte reaktion reduceres permanganat, mens oxalsyre oxideres. Når reaktionen fuldender, ændres den lilla farve af permanganat til farveløs. KMnO 4
+9FeCl
2
+ 8HCl → 5FeCl 3 + MnCl 2 + KCl + 4H 2 O (+ 7) (+2) (+3) (+2) Billedrettighed: 1. Titrering af svag syre med stærk base Ved Quantumkinetics (eget arbejde) [CC BY 3. 0], via Wikimedia Commons 2. "Winkler Titration Prior Titration" af Willwood [CC BY-SA 3. 0] via Commons


