Forskel mellem kombination og dekomponeringsreaktion | Kombination vs dekomponeringsreaktion
Nøgleforskel - Kombination vs dekomponeringsreaktion
En kemisk reaktion er omdannelsen af en eller flere kemiske forbindelser til en eller flere forskellige produkter, der ændrer identiteten af en kemisk forbindelse. Udgangsmaterialet til en kemisk reaktion kaldes reaktanten, og den resulterende forbindelse kaldes produktet. Fordeling af forbindelser eller kombination af forbindelser og dannelse af nye forbindelser vil ske under en kemisk reaktionsproces, da bindingerne mellem atomer af forbindelsen er brudt og oprettet på en anden måde. Kemiske reaktioner kan opdeles i flere brede kategorier. Redox reaktioner eller oxidations-reduktionsreaktioner er meget vigtige blandt dem. Oxiderings- og reduktionsreaktionerne kaldes elektronoverførselsreaktioner, da elektronerne af reaktanter overføres fra en forbindelse til den anden for at forårsage reaktionen. I redoxreaktioner forekommer to parallelle reaktioner, der kaldes halvreaktioner, på samme tid. Disse halv reaktioner viser overførslen af elektroner. Ved at afbalancere disse halvreaktioner kan man gætte den samlede reaktion, der er sket i slutningen. Kombinationsreaktioner og dekomponeringsreaktioner er to hovedtyper af redoxreaktioner. Hovedforskellen mellem kombination og dekomponeringsreaktion er, at kombinationsreaktion involverer en kombination af reaktanter for at give et enkelt produkt , mens dekomponeringsreaktion involverer nedbrydning af en enkelt forbindelse i to eller flere produkter.
INDHOLD
1. Oversigt og nøgleforskel
2. Hvad er en kombinationsreaktion
3. Hvad er en dekomponeringsreaktion
4. Sammenligning ved siden af hinanden - Kombination vs dekomponeringsreaktion
5. Sammendrag
Hvad er en kombinationsreaktion?
En kombinationsreaktion, også kaldet syntesereaktion , er en reaktion, hvori reaktantforbindelser kombineres til dannelse af en anden forbindelse som produktet. Med andre ord resulterer reaktionen af enkle molekyler i et komplekst molekyle. Nogle eller alle bindinger mellem atomer af den pågældende forbindelse er nedbrudt; på samme tid vil atomer kombinere for at danne den nye forbindelse, som er produktet. I dekomponeringsreaktioner virker den samme reaktant som udgangsmaterialet for begge halv reaktioner.I modsætning til i dekomponeringsreaktioner har de halve reaktioner i kombinationsreaktioner til at begynde med forskellige reaktanter. Kombinationsreaktion resulterer i et enkelt produkt. Følgende er et almindeligt eksempel, der kan gives som forbrændingsreaktioner.
For eksempel, når aluminium (Al) placeres i flydende bromid (Br2 ), opstår der en kombinationsreaktion og producerer aluminiumbromid (AlBr 3 ). Her øges oxidationsnummeret i Al og formindskes i Br. Derfor er det en redoxreaktion og er en kombinationsreaktion, da to reaktanter har reageret for at give et bestemt produkt. Figur 01: Kombinationsreaktion
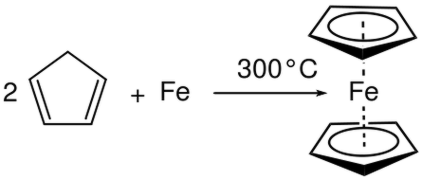
Nedbrydning reaktion er en anden vigtig reaktion i kategorien af redox reaktioner. Det er dybest set det modsatte af kombinationsreaktion. En dekomponeringsreaktion er en reaktion, hvor reaktantforbindelsen nedbrydes til produkter. Her forekommer halvreaktioner på samme tid som oxidationsreaktionen og reduktionsreaktionen. Men i modsætning til i kombination reaktion er reaktanten for begge halv reaktioner den samme i nedbrydning reaktioner. Nedbrydning reaktion resulterer i flere produkter.
Ved elektrolyse af vand nedbrydes vandmolekylerne for at give ilt og hydrogengasser, når strømmen ledes gennem vand. Her øges oxidationsnummeret i oxygenatom og reduceres i hydrogenatom. Derfor er det en redox reaktion og en nedbrydning reaktion på grund af nedbrydning af vandmolekyler i ilt og hydrogen gasser.
Figur 02: Kombination vs dekomponering

Hvad er forskellen mellem kombination og dekomponeringsreaktion?
- diff Artikel Mellem før tabel ->
Kombination vs dekomponeringsreaktion
To eller flere reaktantforbindelser er involveret i kombinationsreaktioner. |
|
| En enkelt forbindelse er involveret i en dekomponeringsreaktion. | Produkter |
| Kombinationsreaktion resulterer i et enkelt produkt. | |
| Nedbrydning reaktioner resulterer i flere produkter. | Halvreaktioner |
| I kombinationsreaktioner har to halv reaktioner to forskellige startmolekyler. | |
| I dekomponeringsreaktioner virker et enkelt molekyle som udgangsmateriale til begge halv reaktioner. | Kemiske bindinger |
| Kombinationsreaktioner resulterer i binding af atomer til fremstilling af enkeltproduktet. | |
| Ved dekomponeringsreaktioner nedbrydes kemiske bindinger for at danne to eller flere slutprodukter. | Molekyler |
| Kombinationsreaktioner forårsager simple molekyler at reagere og producere komplekse molekyler. | |
| Nedbrydning reaktioner forårsager komplekse molekyler at bryde ned i simple molekyler. | Resumé - Kombination vs dekomponeringsreaktion |
Redox reaktioner er meget meget en del af verden omkring os, fordi størstedelen af de vigtige kemiske reaktioner er redox reaktioner. Kombinationsreaktioner og dekomponeringsreaktioner er simple reaktioner, som er modsatte af hinanden. Hovedforskellen mellem kombination og dekomponeringsreaktion er, at kombinationsreaktion involverer kombinationen af to eller flere reaktantmolekyler for at resultere i et enkelt slutprodukt, mens dekomponeringsreaktion involverer nedbrydning af et enkelt molekyle i to eller flere produkter.
Referencer:
1. Chang, R., 2010. kemi. 10. udgave. NewYork: McGraw-Hill.
2. Redox. (2009, juli 30). Hentet 29. maj, 2017, fra // svaginteraktioner. wordpress. dk / primere / redox /
3. Reaktioner. (n. d.). Hentet 29. maj 2017, fra // www. ric. edu / faculty / ptiskus / reactions /
Image Courtesy:
1. "Miller Ferrocen Synthese" af Bert. Kilanowski - eget arbejde (CC0) via Commons Wikimedia
2. "Kemiske reaktioner" Af Daniele Pugliesi - eget arbejde (CC BY-SA 3. 0) via Commons Wikimedia [Beskåret]


