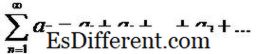Forskel mellem ækvivalens og endpoint
Equivalence Point vs Endpoint
Titrering er en teknik, der i vid udstrækning anvendes i analytisk kemi til bestemmelse af syrer, baser, oxidanter, reduktionsmidler, metalioner og mange andre arter. Ved titrering finder en kendt kemisk reaktion sted. Her reagerer en analyt med et standard reagens kendt som en titrant. En ideel standardløsning, der anvendes i titreringer, skal have flere egenskaber som
Stabilitet• Reager hurtigt med analytten
• Reager fuldstændigt med analysen
• Undergå en selektiv støkiometrisk reaktion med analysen
Nogle gange er en primær standard, som er en stærkt oprenset og stabil løsning, anvendes som referencemateriale i titrimetriske metoder. Analysemængden kan bestemmes, hvis mængden eller massen af titranten, som er nødvendig for at reagere fuldstændigt med analytten, er kendt. Eksperimentelt er titranten i buretten, og analytten sættes til titreringskolben under anvendelse af en pipette. Reaktionen finder sted i titreringskolben. En indikator bruges til at detektere slutpunktet. Nogle gange kan ændring i et instrumentalt svar bruges til at identificere slutpunktet. Instrumenterne registrerer svar på løsningen, som varierer på en karakteristisk måde gennem titrering. Sådanne instrumenter er farveimetre, turbidimetre, ledningsevnemålere, temperaturmonitorer osv. Der er forskellige typer titreringer. "Volumetrisk titrimetri involverer måling af volumenet af en opløsning med kendt koncentration, der er nødvendig for at reagere i det væsentlige fuldstændigt med analytten. "Ved gravimetrisk titrimetri måles reagensmassen i stedet for volumenet. Ved coulometrisk titrimetri måles den tid, der kræves for at fuldende den elektrokemiske reaktion.
I enhver titrering er slutpunkt det punkt, hvor indikatoren ændrer sin farve. Ellers kan en ændring i et instrumentalt svar også bruges til at identificere slutpunktet. For eksempel reagerer HC1 og NaOH 1: 1 og producerer NaCl og vand. Til denne titrering kan vi bruge phenolphthalein indikator, som har en lyserød farve i basismediet og bliver til farveløs i det sure medium. Hvis vi sætter HCl i titreringskolben og til den, hvis vi tilføjer en dråbe phenolphthalein, vil den være farveløs. Under titrering kan vi tilsætte NaOH fra buretten og gradvis vil HCl og NaOH reagere i kolben. Hvis vi tager den samme koncentration af de to opløsninger, når vi tilsætter en lige så meget NaOH til kolben, bliver opløsningen i kolben til en lyserød farve. Dette er det punkt, hvor vi stopper titrering (slutpunkt). Vi overvejer, på dette tidspunkt er reaktionen afsluttet.
ækvivalenspunktet i en titrering er det punkt, hvor den tilsatte titrant er kemisk ækvivalent fuldstændigt til analysen i prøven.Dette er det punkt, hvor den kemiske reaktion er fuldført støkiometrisk. Selv om vi bestemmer slutpunktet fra indikatorfarveændringen, er det måske ikke det reelle endepunkt for reaktionen. Det er, at reaktionen er afsluttet lidt før dette punkt. På dette ækvivalenspunkt er mediet neutralt. Efter tilsætning af et ekstra NaOH-dråbe vil mediet vise den grundlæggende farve af phenolphthalein, som vi tager som slutpunkt.
Hvad er forskellen mellem Equivalence Point og End Point?