Forskel mellem ethanol og ethansyre | Ethanol vs Ethansyre
Nøgleforskel - Ethanol vs Ethanoic Acid
Selvom Ethanol og Ethansyre har lignende navne, kan der observeres en nøgleforskel mellem dem, da de er to forskellige organiske forbindelser indeholdende to forskellige funktionelle grupper. Ethanol er det næstformandste medlem af alkoholfamilien mens ethansyre er det næstnævnte medlem af carboxylsyregruppen. De indeholder begge kun to carbonatomer ud over den funktionelle gruppe, der er til stede i molekylet. Når vi sammenligner deres kemiske egenskaber; begge bruges som organiske opløsningsmidler og besidder en karakteristisk lugt. I modsætning hertil er ethansyre mere sur end ethanol.
Hvad er Ethanol ?
Et almindeligt navn på ethanol er ethylalkohol . Dens funktionelle gruppe er en hydroxylgruppe (-OH gruppe). Alle kemiske egenskaber som reaktivitet, surhed eller basicitet afhænger af den funktionelle gruppe. Ethanol har en meget mild lugt, og det er en flygtig forbindelse. Ethanol er meget vigtigt i sine industrielle anvendelser; Det er et sikkert opløsningsmiddel, en brændstofkilde, der bruges til at producere medicin og kosmetik, og det er den vigtigste komponent i alkoholholdige drikkevarer. Ethanol kan produceres indenlandsk ved hjælp af landbrugsaffald som majs, sukkerrør eller græs.

Hvad er Ethanolsyre syre ?
Det mest anvendte navn for ethansyre er eddikesyre . Det er en farveløs væske med en karakteristisk sur smag og skarp lugt. Den har den molekylære formel af CH 3 COOH. Den ufortyndede form af ethansyren hedder "iseddikesyre", og ca. 3-9% syre pr. Volumen anvendes til fremstilling af eddike. Ethansyre betragtes som en svag syre; men det er ætsende og i stand til at angribe huden.
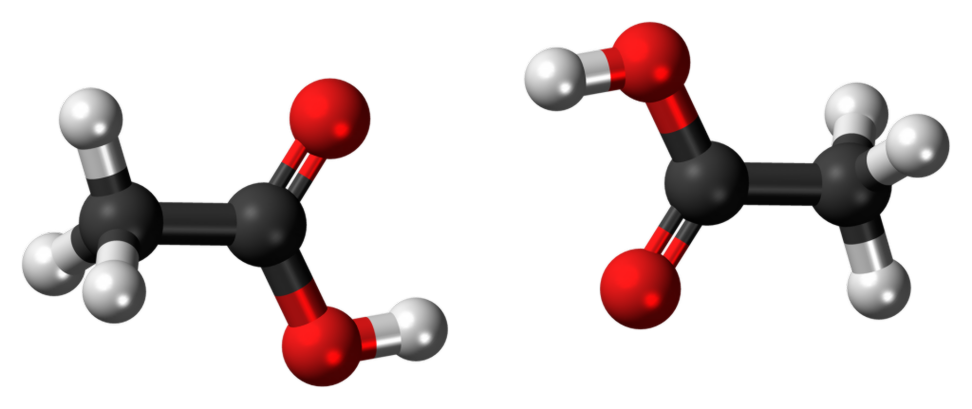
Hvad er forskellen mellem ethanol og ethansyre?
Egenskaber for ethanol og ethansyre:
Funktionsgruppe:
Ethanol: Hydroxylgruppe (-OH-gruppe) er den funktionelle gruppe i ethanol. Det er den karakteristiske egenskab af alkoholer. Alle alkoholer har mindst en -OH gruppe i deres struktur.
Ethansyre: Den funktionelle gruppe i ethansyre er en -COOH-gruppe. Det er almindeligt for alle carboxylsyrer.
Egenskaber:
Ethanol: Ethanol er en monovalent alkohol med en sød lugt, der koger ved 78,5 ° C. Det er det eneste carbonhydrid, der opløses i vand i alle proportioner.Ethanol reagerer med alkalisk KMnO4 for at give ethansyre, mens ethansyre ikke reagerer med alkalisk KMnO4.
Ethansyre: Det er en svag monoprotisk syre i vandig opløsning (pKa = 4, 76). Flydende eddikesyre er et polært opløsningsmiddel som vand. Det opløser både polære væsker, såsom sukkerarter og salte, og ikke-polære væsker, såsom olier og elementer som svovl og iod. Det er let og fuldstændigt blandbart med vandchlorform og hexan. Eddikesyre har en stærk skarp lugt.
Anvendelser:
Ethanol: Ethanol er til stede i alkoholholdige drikkevarer og bruges også som biobrændstof til biler. Det er et godt opløsningsmiddel, der kan opløse mange organiske opløsninger, der er uopløselige i vand. Ethanol bruges til at fremstille mange parfumer, kosmetik og lakker i malingsindustrien.
Etanol som brændstof:
CH 3 CH 2 OH + 3O 2 → 2CO 2 + 3H 2 O Ethansyre:
Eddikesyre anvendes som et kemisk reagens til fremstilling af andre kemikalier. Den anvendes i større mængder til fremstilling af vinylacetatmonomer; Vinylacetat kan polymeriseres til fremstilling af polyvinylchlorid eller andre polymerer. Desuden anvendes eddikesyre til fremstilling af estere, der anvendes i trykfarver, malerier og belægninger. Eddikesyreanhydrid er en anden vigtig kemisk forbindelse, som kan syntetiseres ved kondensering af to molekyler eddikesyre. En lille mængde ethansyre bruges til at producere husholdningseddike. Acidity:
Ethanol:
Ethanol reagerer hverken med natriumbicarbonat (NaHCO3) eller ændrer farven på et blåt litmuspapir. Derfor er det mindre sure end ethansyre. Ethansyre:
Ethansyre er en svag syre, der reagerer med natriumbicarbonat (NaHC03), der frigiver CO2-gas. Det bliver også blåt litmus til rødt. Image Courtesy: "Etanol-3D-bolde". (Public Domain) via Wikimedia Commons "Ædikesyre dimer 3D bold" af Jynto (talk) - eget arbejde. (CC0) via Wikimedia Commons


