Forskel mellem hexan og cyclohexan | Hexan vs Cyclohexan
Nøgleforskel - Hexan vs Cyclohexan
Selvom både hexan og cyclohexan er fra alkanfamilien, er deres fysiske og kemiske egenskaber ikke ens. nøgleforskellen mellem hexan og cyclohexan er, at hexan er en acyklisk alkan , mens cyclohexan er en cyklisk alkan med en ringstruktur . De har begge seks carbonatomer, men et andet antal hydrogenatomer. Dette fører til forskellene i deres molekylære struktur og andre egenskaber. Begge anvendes som organiske opløsningsmidler, men den anden industrielle anvendelse er unik for begge.
Hvad er Hexane?
Hexane (også kendt som n-hexan ) er en farveløs, klar, stærkt flygtig, brændbar organisk væske med petroleumlignende lugt . Det er et alifatisk kulbrinte, der produceres som et biprodukt fra råolieraffinering. Det er uopløseligt i vand og mindre tæt end vand, men dampen er tungere end luft. Hexan er meget reaktivt med visse kemikalier, herunder flydende chlor, koncentreret oxygen og natriumhypochlorit. Det er et farligt stof og forårsager akutte og kroniske helbredsproblemer afhængigt af eksponeringen.

Molekylær struktur af hexan
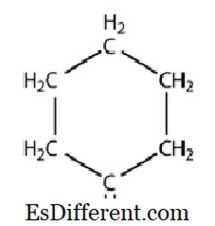
Hvad er cyclohexan?
Cyclohexan er en cyklisk alkan med en enkelt ringstruktur . Det er en klar, farveløs, ikke-polær organisk væske med en mild, sød benzinlignende lugt, der i vid udstrækning anvendes som opløsningsmiddel i kemiske laboratorier. Cyclohexan er en skadelig og farlig forbindelse til både mennesker og dyr, og det betragtes også som en miljøfare. Det er vanduopløseligt væske, men opløses i methanol, ethanol, ether, acetone, benzen, ligroin, carbontetrachlorid.

Hvad er forskellen mellem hexan og cyclohexan?
Molekylformel og struktur:
Hexan: Den molekylære formel af hexan er C 6 H 14 og betragtes som et mættet carbonhydrid. Den har en lige kæde molekylstruktur som vist tidligere.
Cyclohexan: Den molekylære formel af cyclohexan er C 6 H 12 . Det besidder en ringstruktur, som har alle carbonatomer tilsvarende bindinger. Hvert carbonatom er bundet til yderligere to carbonatomer og to hydrogenatomer. Cyclohexan er umættet carbonhydridmolekyle.
Anvendelser:
Hexane: Hexane bruges i vid udstrækning som et opløsningsmiddel til at ekstrahere spiselige olier fra grøntsager og frø samt et rengøringsmiddel.Det bruges også til fremstilling af tyndere i malingsindustrien og anvendes som et kemisk reaktionsmedium.
Cyclohexan: Ren cyclohexan anvendes almindeligvis som et opløsningsmiddel; derudover bruges det i nylonindustrien til at fremstille forstadier såsom adipinsyre og caprolactam til fremstilling af malingforbedringsmidler og andre kemikalier.
Helbredseffekter:
Hexane: Eksponeringen for hexan forårsager både akutte (kortvarige) og kroniske (langvarige) problemer afhængigt af eksponeringsniveauet og tiden. Hvis en person indånder høje niveauer af hexan i en kort periode, kan det forårsage milde centralnervesystemers (CNS) virkninger som svimmelhed, svimmelhed, svag kvalme og hovedpine. Kronisk eksponering for hexan i luften forårsager polyneuropati hos mennesker, med følelsesløshed i ekstremiteterne, muskelsvaghed, sløret syn, hovedpine og træthed. Der er intet bevis fundet, at det har kræftfremkaldende virkninger hos mennesker eller dyr.
Cyclohexan: Det er et giftigt kemikalie; indånding af cyclohexan forårsager hovedpine, svimmelhed, døsighed, inkoordination og eufori. Indtagelse kan forårsage kvalme, opkastning og lejlighedsvis diarré. Hudkontakt forårsager irritation af huden og alvorlige problemer som tørring og revnedannelse kan ske på grund af affedtningsvirkning, hvis det kommer i kontakt med oftere eller over en så lang periode. Oksulær eksponering resulterer i alvorlige problemer som smerte, blepharospasm (ufrivillig tæt lukning af øjenlågene), lacrimation (smørende øjne som følge af irritation), conjunctivitis (betændelse i øjets conjunctiva), palpebral ødem (hævelse af øjenlågene) og fotofobi (ekstrem følsomhed over for lys).
Image Courtesy:
1. Hexane-2D-flat-A Af Ben Mills (eget arbejde) [Public domain], via Wikimedia Commons
2. Cyclohexan med H Ved Calvero. (Selfmade with ChemDraw.) [Public domain], via Wikimedia Commons




