Forskel mellem hydrolyse og kondensation
Hydrolyse vs kondensation
Kondensation og hydrolyse er to typer kemiske reaktioner, der er involveret i bindingsdannelse og bindingsbrud. Kondensation er den modsatte af hydrolyse. Disse to typer reaktioner findes almindeligvis inden for biologiske systemer, og vi bruger også disse reaktioner til at opnå mange kommercielt vigtige produkter.
Kondensation
Kondensationsreaktioner er en type kemisk reaktion, hvor små molekyler mødes for at danne et stort enkeltmolekyle. Reaktionen finder sted inden for to funktionelle grupper i molekylerne. Andet karakteristisk træk ved en kondensationsreaktion er, at et lille molekyle går tabt under reaktionen. Dette molekyle kan være vand, hydrogenchlorid, eddikesyre, etc. Hvis det tabte molekyle er vand, er disse typer kondensationsreaktioner kendt som dehydreringsreaktioner. Da reaktantmolekylerne er mindre og produktmolekylet er meget stort, vil tætheden af produkter altid være højere end reaktionerne i kondensationsreaktioner. Kondensationsreaktioner finder sted på flere måder. For eksempel kan vi i vidt omfang opdele disse i to typer som intermolekylære kondensationsreaktioner og intra-molekylære kondensationsreaktioner. Hvis de to funktionelle grupper er bosat i det samme molekyle, er de kendt som intra-molekylære kondensationer. For eksempel har glucose en lineær struktur som følger.
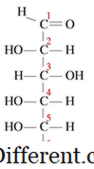
I en opløsning er størstedelen af molekylerne i en cyklisk struktur. Når en cyklisk struktur dannes, omdannes -OH på carbon 5 til etherbindingen for at lukke ringen med carbon 1. Dette danner en seks-medlems hemiacetal ringstruktur. Under denne intramolekylære kondensationsreaktion afstødes et vandmolekyle, og der dannes en etherbinding. Intermolekylære reaktioner producerer mange nyttige og fælles produkter. Under dette sker reaktionen mellem de funktionelle grupper af to separate molekyler. For eksempel kondenseres aminosyrer ved dannelse af et makromolekyle som protein. Et vandmolekyle frigives, og der dannes en amidbinding, som er kendt som en peptidbinding. Når to aminosyrer bindes sammen, dannes et dipeptid, og når mange aminosyrer er forbundet, kaldes det et polypeptid. DNA og RNA er også dannet af to makromolekyler som følge af kondensationsreaktioner mellem nukleotider. Kondensationsreaktioner producerer meget store molekyler, og nogle gange er molekylerne ikke så store. For eksempel: i esterificeringsreaktionen mellem en alkohol og en carboxylsyre, dannes et lille estermolekyle, hvis det dannes. Kondensation er vigtig i polymerdannelse. Polymerer er store molekyler, som har den samme strukturelle enhed, der gentager igen og igen.De gentagende enheder kaldes monomerer. Disse monomerer bindes til hinanden med kovalente bindinger til dannelse af en polymer.
Hydrolyse
Dette er en reaktion, hvor en kemisk binding brydes ved hjælp af et vandmolekyle. Under denne reaktion opdeles et vandmolekyle i en proton og en hydroxidion. Og så tilføjes disse to ioner til de to dele af molekylet, hvor bindingen er brudt. For eksempel er følgende en ester. Esterbindingen er mellem -CO og -O.

I hydrolysen tilføjer protonen fra vandet til -O siden, og hydroxidionen tilføjer til -CO-siden. Derfor vil der som følge af hydrolysen dannes en alkohol og en carboxylsyre, som var reaktanterne, når de danner esteren.
|
Hvad er forskellen mellem hydrolyse og kondensation? • Hydrolyse er det modsatte af kondensering. • Kondensationsreaktioner gør kemiske bindinger, mens hydrolyse bryder kemiske bindinger. • Polymerer fremstilles ved kondensationsreaktioner, og de brydes af hydrolysereaktioner. • Under kondensereaktioner kan vandmolekyl frigives. I hydrolysereaktionerne indarbejdes vandmolekyle i molekylet. |


