Forskel mellem lysin og L-lysin | Lysin vs L-lysin
Nøgleforskel - Lysin vs L-lysin
Lysin og L-lysin er begge typer aminosyrer, der deler samme fysiske egenskaber, men der er en vis forskel mellem dem. nøgleforskellen mellem lysin og L-lysin er i evnen til at rotere plane polariseret lys. Lysin er en biologisk aktiv naturligt forekommende essentiel a-aminosyre. Det kan forekomme i to isomere former på grund af muligheden for at danne to forskellige enantiomerer omkring det chirale carbonatom. Disse er kendt som L- og D-former, analoge med venstrehåndede og højrehåndede konfigurationer. Disse L- og D-former siges at være optisk aktive og rotere plane polariseret lys i en anden forstand; med uret eller mod uret Hvis lyset roterer lysin mod uret, viser lyset levorotation, og det er kendt som L-lysin. Det skal dog her omhyggeligt bemærkes, at D- og L-mærkning af isomerer ikke er det samme som d- og l-mærkning.
Hvad er Lysine?
Lysin er en essentiel aminosyre som er ikke syntetiseret i vores krop og skal leveres af den regelmæssige diæt. Derfor er lysin en væsentlig aminosyre for mennesker. Det er en biologisk vigtig organisk forbindelse sammensat af amin (-NH 2 ) og carboxylsyre (-COOH) funktionelle grupper med kemisk formel NH 2 - (CH 2) 4 -CH (NH 2 ) - COOH. Nøgleelementerne i lysin er carbon, hydrogen, oxygen og nitrogen. I biokemi er aminosyrer med både aminen og carboxylsyregrupperne bundet til det første (alfa) carbonatom kendt som a-aminosyrer . Således betragtes lysin også som a-aminosyrer. Lysins struktur er angivet i figur 1. Figur 2: Lysinsammensætning (* carbonatom er et chiralt eller asymmetrisk carbonatom og repræsenterer også alfa-carbonatomet). Lysin er grundlæggende i naturen, fordi den indeholder to basiske amino grupper og en sur carboxylsyregruppe. Derfor danner det også omfattende hydrogenbinding på grund af tilstedeværelsen af to aminogrupper.
Gode kilder til lysin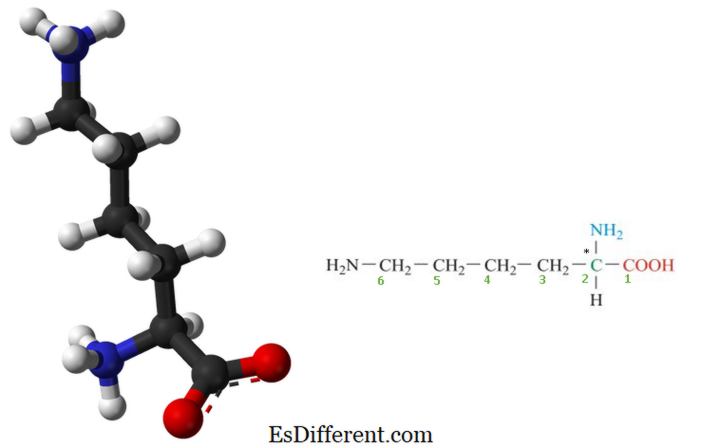
er proteinrige dyrekilder som
æg, rødt kød, lam, svinekød og fjerkræ, ost og visse fisk (såsom torsk og sardiner). Lysin er også rig på planteproteiner som soja, bønner og ærter. Det er imidlertid en begrænsende aminosyre i de fleste kornkorn, men er rigelig i de fleste pulser og bælgplanter.
carbon, og det er
asymmetrisk struktur .Lysin er også en optisk aktiv aminosyre på grund af tilstedeværelsen af dette asymmetriske eller chirale carbonatom. Lysin kan således skabe stereoisomerer, der er isomere molekyler med samme molekylformel, men adskiller sig i de tredimensionale orienteringer af deres atomer i rummet. Enantiomerer er to stereoisomerer, der er relateret til hinanden ved en refleksion, eller de er spejlbilleder af hinanden, der ikke er overlejrede. Lysin er tilgængelig i to enantiomere former kendt som L- og D-, og lysin-enantiomererne er angivet i figur 2. Figur 2: Enantiomerer af lysinaminosyre. Grupperne COOH, H, R og NH2 er anbragt omkring C-atomet i retning med uret, enantiomeren kaldes L-form og D-form på anden måde. L- og D- henviser kun til rumlige arrangementer omkring carbonatomet og henviser ikke til optisk aktivitet. Mens L- og D-formerne i et chiralt molekyle roterer planet af polariseret lys i forskellige retninger, roterer nogle L-former (eller D-former) lys til venstre (levo eller l-form) og nogle til højre (dextro eller d-form). l- og d-former kaldes optiske isomerer. L-lysin og D-lysin er enantiomerer af hinanden, har de samme fysiske egenskaber, bortset fra den retning, hvori de roterer polariseret lys. De har ikke-overlejret spejlbillede forhold. Nomenklaturen for D og L er imidlertid ikke almindelig i aminosyrer, herunder lysin. De roterer det plane polariserede lys i samme størrelsesorden men i forskellige retninger. Lysin D og L-isomeren, der roterer det plane polariserede lys i urets retning, kaldes som dextrorotatoriske eller d-lysin
 , og den, som roterer det polariserede polariserede lys mod uret, kaldes som laevorotatorisk eller
, og den, som roterer det polariserede polariserede lys mod uret, kaldes som laevorotatorisk eller
L-lysin (Figur 2). L-Lysin er den mest tilgængelige stabile form af lysin . D-Lysin er en syntetisk form af lysin og kan syntetiseres fra l-lysin ved racemisering. Det anvendes til behandling af poly-d-lysin, som anvendes som et belægningsmateriale til forøgelse af cellefastgørelsen. L-Lysin spiller en væsentlig rolle i menneskekroppen, i calciumabsorptionen, udviklingen af muskelprotein og syntese af hormoner, enzymer og antistoffer. Industrielt fremstilles L-lysin ved en mikrobiel fermenteringsproces under anvendelse af
Corynebacterium glutamicum . Hvad er forskellen mellem lysin og L-lysin? Lysin og L-lysin har de samme fysiske egenskaber, bortset fra den retning, hvori de roterer polariseret lys. Som et resultat kan L-lysin have væsentligt forskellige biologiske virkninger og funktionelle egenskaber. Der er imidlertid foretaget meget begrænset forskning for at skelne mellem disse biologiske effekter og funktionelle egenskaber. Nogle af disse forskelle kan omfatte, Smag
L-lysin:
L-former for aminosyrer har en tendens til at være usmageligt.
D-lysin:
D-former af aminosyrer har tendens til at smage sødt. Derfor kan l-lysin være mindre / ikke sødere end lysin.
Overflod L-lysin:
L-formerne af aminosyre, herunder l-lysin, er den mest rigelige form i naturen.Som et eksempel er ni af de nitten L-aminosyrer, der almindeligvis findes i proteiner, dextroroterende, og resten er levorotatoriske.
D-lysin:
D-formerne af aminosyrer, der blev observeret eksperimentelt, viste sig at forekomme meget sjældent. Referencer: Solomons, T.W. Graham, og Graig B. Fryhle (2004). Organisk kemi (8
th ed). Hoboken: John Wiley & Sons, Inc. Everhardus, A. (1984). Stereokemi, et grundlag for sofistikeret nonsens i farmakokinetik og klinisk farmakologi, European Journal of Clinical Pharmacology, 26 , 663-668. Image Courtesy: "L-lysinmonokation-fra-hydrochlorid-dihydrat-xtal-3D-bolde" af Ben Mills - Egent arbejde via Wikimedia Commons




