Forskel mellem delvist tryk og damptryk Forskel mellem
Delvist tryk og damptryk videnskabelige termer vedrørende mængden af tryk udøvet af systemkomponenter, men deres identitet kan forvirre andre. Der er en klar sondring mellem disse vilkår, herunder deres virkninger og identitet. Denne artikel vil uddybe mere om forskellene mellem disse vilkår. Det vil også indeholde nogle eksempler til at demystificere applikationerne deraf.
Lad os begynde med at fremhæve tryktanken, inden vi kan dykke ind i sondringen mellem damp og partialtryk. Tryk er videnskabeligt defineret som den kraft, der påføres pr. Arealareal på en genstand eller et stof. Det kan også defineres som den kraft, der påføres af de kolliderende partikler på hinanden, og det måles ofte ved anvendelse af Pascal. I tilfælde af partikelkollision anvendes gasekvationen og kinetisk teori for gasser til at beregne trykket.
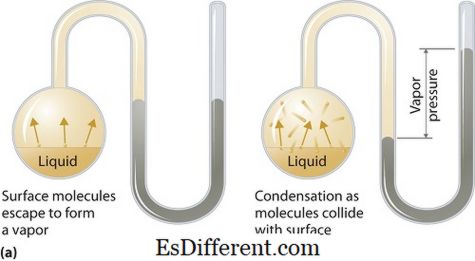
Hvad er damptryk?
Damptryk kan anvendes i flydende eller faste faser. Det er trykket, der udøves af dampen i dets termodynamiske ligevægt på dets flydende eller faste tilstand ved en given temperatur i et lukket system, når både dampen og væsken (faststof) er i kontakt. Dette tryk opstår som et resultat af fordampning, som aktiveres af en forøget varme på faststoffet eller væsken. Således anvendes temperaturen som måling af fordampning, og den er direkte proportional med damptrykket. Dette betyder, jo højere temperaturen er, desto højere er damptrykket.
Under fordampning undslipper luftmolekylerne som følge af den højere kinetiske energi til luften i et lukket system. Så når der er ligevægt opstår damptrykket mellem dampen og dens kondenserede form af væske (faststof). I løsninger, hvor de intermolekylære kræfter er svagere, har damptrykket tendens til at være mere, og omvendt i opløsninger, hvor de intermolekylære kræfter er stærkere, er damptrykket mindre.
Damptrykket kan også forekomme i ideelle blandinger som forklaret af Raoults lov. Den anfører, at partielt damptryk af en bestemt bestanddel i en flydende eller fast blanding er lig med damptrykket af den komponent multipliceret med sin molfraktion i den pågældende blanding ved en given temperatur. Eksemplet nedenfor illustrerer det.
Eksempel 1.
Givet en ideel blanding af 0,5 mol. ethanol og 1, 5 mol. methanol med damptrykket på henholdsvis 30 KPa og 52 KPa, bestemmer partielt damptryk af hver komponent.
Løsning:
Det samlede antal mol er 1. 5mol + 0. 5mol = 2. 0mol. Ifølge Raoults lov er det partielle damptryk lig med damptrykket multipliceret med den molære fraktion af den pågældende komponent.I dette tilfælde er P methanol = 1 5/2 * 52 = 39KPa og P ethanol = 0,525 * 30 = 7,5KPa.
Når du har de partielle damptryk af komponenterne i blandingen, kan du få det samlede damptryk ved at tilføje dem sammen. I denne henseende giver 7,5 + 39 46. 5KPa totalt damptryk af blandingen af ethanol- og methanolopløsninger.
Faktorer der påvirker damptrykket
Molekylidentitet
Som allerede nævnt bestemmer typerne af molekylære kræfter mængden af damptryk, der skal udøves. Hvis kræfterne er stærkere, opstår der mindre damptryk, og hvis svagere, opstår der mere damptryk. Derfor vil sammensætningen af væsken eller det faste stof påvirke damptrykket.
Temperatur
Højere temperatur fører til højere damptryk, fordi det aktiverer mere kinetisk energi for at bryde de molekylære kræfter, så molekylerne hurtigt kan slippe væk fra den flydende overflade. Når damptrykket (mættet damptryk) svarer til det ydre tryk (atmosfærisk tryk), begynder væsken at koge. En lavere temperatur vil resultere i lavt damptryk, og det vil tage tid for væsken at koge.

Daltons lov om delvistryk
Hvad er partialtryk?
Ideen om delvis pres blev først foreslået af den berømte forsker John Dalton. Det fødte sin delpreslove, hvori det hedder, at det samlede tryk, der udøves af en ideel blanding af gasser, svarer til summen af partialtryk af individuelle gasser. Sig, at en bestemt beholder er fyldt med hydrogen-, nitrogen- og oxygengasser, det samlede tryk, P TOTAL, vil svare til summen af ilt, nitrogen og hydrogen. Partialtrykket af enhver gas i den blanding beregnes ved at multiplicere det samlede tryk med den molære fraktion af den enkelte gas.
I et nøddeskal er partialtryk det tryk, der udøves af en bestemt gas i blandingen, som om den virkede alene i systemet. Således ignorerer du andre gasser, når du bestemmer partialtrykket af en individuel gas. Denne teori kan verificeres ved at injicere 0. 6atm O 2 i en 10. 0 L beholder ved en 230K og derefter injicere 0. 4atm N 2 i en identisk beholder af samme størrelse ved samme temperatur, og derefter i sidste ende kombinere gasserne for at måle det samlede tryk; det vil være summen af de to gasser. Dette forklarer klart partialtrykket af en individuel gas i en blanding af ikke-reaktive gasser.
Beregning af partialtrykket
For at beregne partialtrykket er en absolut brise, da Daltons lov [1] indeholder bestemmelser herom. Det afhænger af typiske oplysninger. Hvis for eksempel det samlede tryk gives for en blanding af gas A og B såvel som trykket af gas A, kan partialtrykket af B beregnes ved anvendelse af P TOTAL = P A + P B . Resten er algebraiske manipulationer. Men i tilfælde hvor kun det samlede tryk af blandingen er givet, kan du bruge den molære fraktion af gas B til at bestemme er partialtryk.Den molære fraktion, der betegnes med X, kan findes ved at dividere molene af gas B med de totale mol af gasblandingen. Derefter for at finde partialtrykket multiplicerer du den molære fraktion, X, med det totale tryk. Eksemplet nedenfor uddyber det.
Eksempel 2.
En blanding af kvælstof og oxygen med henholdsvis 2, 5 mol og 1,85 mol injiceres i en 20 0 liter beholder med et totalt tryk på 4atm; beregne det partialtryk, der udøves af oxygengasen.
Løsning:
Det totale antal mol i blandingen er 2. 5 + 1. 85 = 4. 35 mol. Så den molære fraktion af oxygen, X o , vil være 1,85 mol / 4. 35 mol = 0,42 mol. Det partiske tryk af oxygen vil være 0. 425 * 4atm = 1. 7atm. Partialtrykket af den resterende gas kan beregnes efter samme fremgangsmåde eller kan beregnes ved anvendelse af oxygengasen og det samlede tryk som udarbejdet af Daltons lov om deltryk, at det totale tryk af ikke-reaktive gasser er lig med summen af de delvise tryk.
Forskel mellem damp og partialtryk
Det fremgår af ovenstående forklaringer, at damptryk og partialtryk er to forskellige tryk. Damptryk gælder i flydende og faste faser, mens partialtrykket gælder for gasfasen. Damptrykket udøves i faseovergang, efter at tilstrækkelig varme er blevet tilsat til opløsningen, hvilket fører til dets molekyler at undslippe i et lukket system.
Hovedforskellen mellem partialtryk og damptryk er, at partialtryk er trykket, der udøves af en individuel gas i en blanding, som om det var alene i dette system, medens damptrykket refererer til det tryk, der udøves af dampen i dets termodynamisk ligevægt med dens kondenserede tilstand af væske eller faststof. Tabellen nedenfor giver en kort sammenligning af disse tryk.
| Damptryk | Delvist tryk |
| Den udøves af flydende eller fast damp i dens kondenserede fase i ligevægt | Den udøves af individuelle gasser i en ikke-reaktiv gasblanding |
| Godt forklaret af Raoults Lov | Godt forklaret af Daltons lov |
| Anvendes i faste og flydende faser | Gælder kun i gasfaser |
| Uafhængigt af overfladen eller systemets volumen | Beregnet ved anvendelse af gasser i samme volumen |
| Beregnet ved anvendelse af molfraktionen af opløst stof | Beregnet ved anvendelse af molfraktionen af gassen |
Wrap Up!
Damptryk og partialtryk er to vigtige videnskabelige udtryk, der anvendes til bestemmelse af virkningerne af de kræfter, der påføres henholdsvis dampen og gassen, i givet lukket system ved bestemte temperaturer. Deres største forskel er applikationsområdet med damptrykket på væskeformige eller faste faser, medens partialtrykket påføres en enkelt gas i en blanding af ideelle gasser i et givet volumen.
Deltrykket beregnes let ved at følge Daltons lov om delvistryk, mens damptrykket beregnes ved at anvende Raoults lov.I en given blanding udøver hver gaskomponent sit eget tryk, hvilket kaldes partialtrykket uafhængigt af andre gasser. Og når du fordobler molene af en hvilken som helst komponent med den resterende temperatur konstant, vil du øge dets partialtryk. Ifølge Clausius-Clapeyron-forholdet [2] øges damptrykket, da temperaturen stiger.
Med de ovennævnte oplysninger skal du kunne skelne mellem damptryk og partialtryk. Du skal også kunne beregne dem ved hjælp af de molære fraktioner og multiplicere med det samlede tryk. Vi har givet dig typiske eksempler til at uddybe anvendelsen af disse pres.




