Forskel mellem Sigma og Pi-bindingen Forskel mellem
Hvad er Sigma-binding?
Sigma-bindinger er bindinger mellem atomer inden for molekyler dannet langs aksen, der forbinder de bundne kerner af atomerne.
Molekylære bindinger
Molekyler danner når atomer udveksler eller deler elektroner gennem kemisk binding. Der er i det væsentlige tre typer obligationer. Joniske bindinger, metalliske bindinger og kovalente bindinger. I ioniske bindinger vil atomerne simpelthen bytte en elektron, så at et atom vil blive positivt ladet og det andet negativt ladet, hvilket får dem til at blive tiltrukket af den elektromagnetiske kraft. I metalliske bindinger vil elektroner fordeles ensartet gennem hele molekylet og skabe et hav af frie, delokaliserede elektroner, der omslutter positivt ladede ioner tiltrukket af elektronerne.
Inden for kovalente bindinger deles elektroner, og den måde, de deles på, er gennem elektronernes sandsynlighed, og de orbitaler, hvor de er placeret, overlapper på en måde, der er omtrent symmetrisk.
Orbitaler og sigma-obligationer
Orbitaler er regioner omkring atomer forbundet med bestemte energiniveauer. Elektroner i orbitaler længere fra kernen vil have mere energi end elektroner i orbitaler tættere på kernen. Når orbitalerne af et atom overlapper med orbitalerne fra et andet atom, danner de molekylære orbitaler, der tillader molekylære bindinger, der naturligvis tillader molekyler.
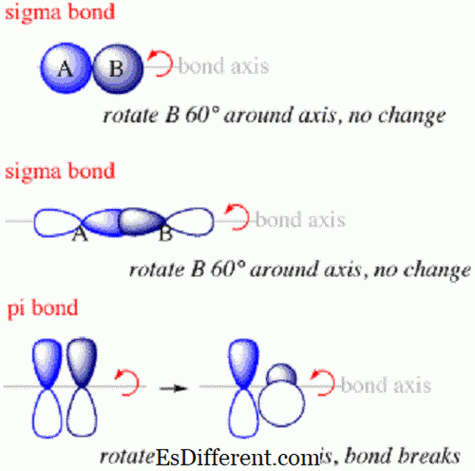
Sigma-obligationer er den første type binding, som vil danne mellem atomer. Inden for en sigma-binding vil elektrons sandsynlighedsskyerne være langs aksen, der forbinder kernerne af de bundne atomer. Sigma-bindinger vil typisk dannes, når s orbitaler fra forskellige atomer overlapper hinanden for at skabe en binding. De vil altid danne sig langs aksen mellem de to kerner, fordi s kredsløb er arrangeret i noget som en kugle rundt om kernen.
Sigma-bindinger og sigma-orbitaler
De elektroner, der udgør sigmabindingen, vil være inden for sigma-orbitalerne og vil således være et sted langs aksen, der forbinder kernerne i de bundne atomer. Sigma-bindingen kan imidlertid være stabil eller ustabil afhængig af om elektronerne er i en sigmabindingsorbital eller et anti-bindende orbitalt.
Sigma-bindingsorbitaler vil være i rummet mellem kernerne, mens anti-bindende orbitaler vil være langs aksen, der forbinder kernerne, men på siderne af atomerne modsat rummet mellem dem. Sigma-bindingen vil være stabil, hvis flere elektroner er i bindingsorbitalerne og ustabile, hvis flere er i de antiblokerende orbitaler, eller hvis der er et lige antal elektroner i begge.
Hvad er Pi-binding?
Pi-bindinger er bindinger mellem atomer inden for molekyler, hvor elektronerne er over og under aksen, der forbinder kernerne i de tilsluttede atomer, men ikke langs aksen.De er den anden type binding, der vil danne sig inden for et molekyle efter sigmabindingen.
Pi-bindinger og p orbitaler
Grunden til, at pi-bindinger danner over og under bindingsaksen, men ikke langs den er, fordi de normalt danner fra overlappende orbitaler som p orbitaler på de bundne atomer. Disse orbitaler har ikke en elektrondensitet ved kernen. Som følge heraf vil de elektroner, der udgør pi-bindingerne, der danner fra de overlappende p orbitaler altid klynge i et område, der ikke er direkte tilstødende til kernen. Pi-bindinger kan også danne sig mellem andre atomorbitaler, såsom d orbitaler, som har træk fælles med p orbitaler.
Pi-bindinger og pi-orbitaler
Når p orbitaler af forskellige atomer overlapper hinanden, skaber de molekylære pi-orbitaler, der tillader pi-bindinger at danne. Obligationen kan igen være stabil eller ustabil afhængig af kredsløbet, hvor elektronen er placeret. Pi-bindingen vil være stabil, hvis flere elektroner er i pi-bindingsorbitalerne. Det vil være ustabilt, hvis flere er i de anti-bindende orbitaler, eller hvis et lige antal er i begge.
Ligheder mellem sigma-bindinger og pi-bindinger
Sigma-bindinger og pi-bindinger er begge baseret på specifikke molekylære orbitaler, der er afledt af overlapning af bestemte atomorbitaler, fx s orbitaler i sagen af sigma-bindinger og p orbitaler i tilfælde af pi-bindinger. De kan også være stabile eller ustabile, afhængigt af om elektroner er i bindingsmolekylære orbitaler eller anti-bindende molekylære orbitaler.
Forskelle mellem sigma-obligationer og pi-obligationer
På trods af deres ligheder er der vigtige forskelle.
- Elektroner, der udgør sigmaobligationer, vil blive fordelt i rummet langs aksen, der forbinder de sammenføjede kerner, mens elektroner i pi-bindinger vil blive fordelt over og under aksen, men ikke langs den.
- Sigma-bindinger er de første bindinger, der danner mellem atomer inden for molekyler, mens pi-bindinger er det andet.
- Sigma-bindinger dannes ofte ved kombinationen af s orbitaler i forskellige atomer, medens pi-bindinger dannes fra kombinationen af p og lignende orbitaler i forskellige atomer.
- Derudover vil orienteringen af overlappende orbitaler, der danner pi-bindinger, være vinkelret på den for overlappende orbitaler, der danner sigma-bindinger.
Sigma-bindinger vs. pi-bindinger
| Sigma-binding | Pi-binding |
| Atom-orbitaler overlapper langs bindingsakse | Atom-orbitaler overlapper over og under bindingsakse |
| Første bindinger til dannelse mellem atomer i molekyler | Andre obligationer til dannelse mellem atomer inden for molekyler |
| Formet fra overlappende orbitaler som s orbitaler | Formet fra overlappende orbitaler som p orbitaler |
| Overlappende orbitaler vinkelret på pi-bindingerne | Overlappende orbitaler vinkelret på sigma-bindingerne |
Sammenfatning: Sigma og Pi-bindinger
Sigma-bindingen er en binding mellem atomer inden for et molekyle, der ofte dannes ved s < orbitaler overlappende langs aksen, der forbinder de tilsluttede kerner.Den er den første til at danne, og dens stabilitet afhænger af, hvordan elektronerne distribueres i sigmabindingen og antibakterielle orbitaler. Pi-bindinger er molekylære bindinger dannet ofte fra overlappende p orbitaler fra forskellige atomer. De elektroner, der udgør pi-bindinger, vil blive fordelt over og under aksen, der forbinder de bundet atomer, men ikke langs aksen. Stabiliteten af disse bindinger afhænger også af bindings- og antibondenserende pi-orbitaler. Sigma-bindinger vil være de første bindinger, der dannes inden for molekyler, mens pi-bindinger vil være de andre bindinger til dannelse. Pi-bindinger danner også fra atomorbitaler, der er orienteret vinkelret på dem, der udgør sigmabindinger.




