Forskel mellem ammoniumnitrat og urinstof
Ammoniumnitrat vs urinstof
Forbindelser indeholdende nitrogen er almindeligt anvendt som gødning, fordi nitrogen er et af de meget væsentlige elementer til plantevækst og udvikling. Ammoniumnitrat og urinstof er sådanne nitrogenholdige faste stoffer.
Ammoniumnitrat
Ammoniumnitrat har den kemiske formel af NH 4 NO 3 . Dette er nitrat af ammoniak, og den har følgende struktur.

Ved stuetemperatur og standardtryk findes ammoniumnitrat som et lugtfri, hvidt krystallinsk faststof. Dette er et surt salt med en pH på ca. 5. 4. Den molære masse er 80,052 g / mol. Smeltepunktet af ammoniumnitrat er ca. 170 ° C, og det dekomponerer ved opvarmning til ca. 210 o C. Ammoniumnitrat anvendes primært til landbrugsformål. Den er rig på kvælstof, så den bruges som gødning til at levere kvælstof til planter. Da den direkte kontakt med kemikalier ikke er farlig, og den er mindre giftig, er den fordelagtig at bruge som gødning. Desuden får opvarmning eller antændelse ammoniumnitrat til at eksplodere. Derfor bruges den som et oxidationsmiddel i eksplosivstoffer. På grund af denne eksplosive natur bør vi være ekstra forsigtige ved opbevaring af ammoniumnitrat. Ammoniumnitrat er stabilt, men når det er i smeltet tilstand er risikoen for eksplosion højere. Risikoen stiger, hvis det kommer i kontakt med oxiderbare materialer som olie, diesel, papir, klud eller halm. Produktion af ammoniumnitrat er en simpel kemisk reaktion. Når salpetersyre omsættes med ammoniakvæske, produceres ammoniumnitrat i opløsningsformen. Industrielt koncentreret salpetersyre og ammoniakgas anvendes til produktion. Da dette er en meget eksoterm og voldelig reaktion, er det udfordrende at producere det i stor skala. At være et salt er ammoniumnitrat meget opløseligt i vand. Derfor kan det, når det bruges som gødning, vaskes og akkumuleres i vandlegemer. Dette kan være en dødelig tilstand for vandlevende.
Urea Urea har molekylformlen af CO (NH
2 ) 2 og den følgende struktur. Det er et carbamid med den funktionelle gruppe C = O. To NH
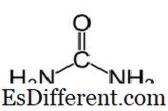
2 grupper er bundet til carbonylcarbonet fra to sider. Urea fremstilles naturligt i pattedyr i nitrogenstofskifte. Dette kaldes urinstofcyklussen, og oxidation af ammoniak eller aminosyrer producerer urinstof inde i vores krop. Det meste af urinstof udskilles via nyrer med urin, mens nogle udskilles med sved. Uopløseligheden af urea er nyttig, når den udskilles fra kroppen. Urea er et farveløst, lugtfri faststof, og det er ikke-toksisk. Ud over at være et metabolisk produkt, er det primært at producere gødning.Urea er en af de mest almindelige nitrogenudslipende gødninger, og den har et højt nitrogenindhold sammenlignet med andre faste nitrogenholdige gødningsstoffer. I jord omdannes urea til ammoniak og kuldioxid. Denne ammoniak kan omdannes til nitrit med jordbakterier. Desuden anvendes urea til fremstilling af sprængstoffer som urinstofnitrat. Det bruges også som råmateriale til fremstilling af kemikalier som plast og klæbemidler.



