Forskel mellem første og anden ionisering energi | Første og anden ioniseringsenergi
Nøgleforskel - Første vs anden ioniseringsenergi (I1E vs I2E)
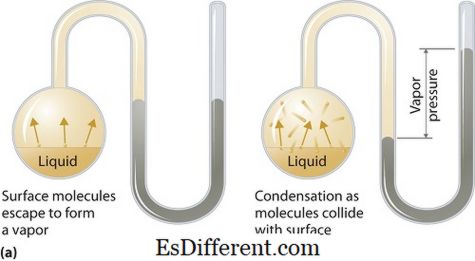
Før analyse af forskellen mellem første og anden ioniseringsenergi, lad os først diskutere hvad ioniseringsenergi er. I almindelighed omtales ioniseringsenergien som den energi, der kræves for at fjerne en elektron fra et gasformigt atom eller en ion. Da elektroner er tiltrukket af den positive kerne, skal energien leveres til denne proces. Dette betragtes som en endoterm proces. Joniseringsenergierne udtrykkes i kJ mol -1 . nøgleforskel mellem første og anden ioniseringsenergi er bedst forklaret i deres definitioner; Den energi, der absorberes af et neutralt, gasformigt atom for at producere en ladet ion (for at fjerne en elektron) kaldes første ioniseringsenergi mens energien absorberes af en positivt ladet (+1) gasformig ion til fremstilling af ion med en +2 ladning kaldes den anden ioniseringsenergi. Joniseringsenergien beregnes for 1 mol atomer eller ioner. Med andre ord; Første ioniseringsenergi vedrører neutrale gasformige atomer, og anden ioniseringsenergi vedrører de gasformige ioner med en (+1) ladning. Størrelsen af ioniseringsenergien varierer afhængigt af ladningen af kernen, afstanden af elektronens form af kernen og antallet af elektroner mellem kernen og de ydre skalelektroner.
Hvad er første ioniseringsenergi (I 1 E)?
Den første ioniseringsenergi defineres som energien absorberet af 1 mol neutrale gasatomer for at fjerne den mest løst bundne elektron fra atom til fremstilling af 1 mol gasformige ioner med +1 ladning. Størrelsen af den første ioniseringsenergi stiger langs en periode i det periodiske bord og falder langs en gruppe. Første ioniseringsenergi har periodicitet; Den har det samme mønster gentagne gange langs det periodiske bord.
Hvad er anden ioniseringsenergi (I 2 E)?
Den anden ioniseringsenergi defineres som den energi, der absorberes af 1 mol positivt ladede gasformige ioner for at producere 1 mol gasformige ioner med en +2 ladning ved at fjerne den løst bundne elektron fra +1-ionet. Anden ioniseringsenergi viser også periodicitet.

Hvad er forskellen mellem første og anden ioniseringsenergi (I 1 E og I 2 E)?
Definition af Første og anden ioniseringsenergi
Første ioniseringsenergi (I 1 E): Den energi, der kræves for at fjerne den mest løst bundne elektron fra 1 mol gasformige atomer til fremstilling af 1 mol gasformige ioner med en positiv ladning (+1).
(9 mol) (1 mol) (1 mol) (1 mol) (g) > Andre ioniseringsenergi (I 2 E): Den energi, der kræves for at fjerne den mest løst bundne elektron fra 1 mol gasformige ioner med en +1-ladning for at producere mol af gasformige ioner med +2 ladning.
X
+ (g) X 2+
(g) + e - (1 mol) (1 mol) 1 mol) Egenskaber ved første og anden ionisering Energi Energikrav Normalt udstødning af den første elektron fra et jordformigt gasformigt atom er lettere end udstødning af den anden elektron fra en positivt ladet ion. Derfor er første ioniseringsenergi mindre end den anden ioniseringsenergi, og energiforskellen mellem første og anden ioniseringsenergi er signifikant stor.
- diff Artikel Mellem før tabel ->
Element
Første ioniseringsenergi (I
1 E)
/| kJ mol | -1 Anden ionisering energi (I 2 E ) / kJ mol | -1 Hydrogen (H) 1312 Helium (He) 2372 5250 Litium (Li) |
| 520 | 7292 | |
| Beryllium (Be) | 899 | 1757 |
| Bore (B) | 800 | 2426 |
| Kulstof (C) | 1086 | 2352 |
| Nitrogen (N) | 1402 | 2855 |
| Oxygen (O) | 1314 | 3388 |
| Fluor (F) < 680 | 3375 | Neon (Ne) |
| 2080 | 3963 | Natrium (Na) |
| 496 | 4563 | Magnesium (Mg) |
| 737 1450 | Tendensen af ioniseringsenergien i det periodiske bord | Første ioniseringsenergi (I |
| 1 | E): | Atomerets første ioniseringsenergiværdier i hver periode viser den samme variation. Magnitude er altid mindre end den anden ioniseringsenergiværdi |
| Anden ioniseringsenergi (I | 2 | E): |
Andre ioniseringsenergiværdier af atomer i hver periode viser den samme variation; Disse værdier er altid højere end de første ioniseringsenergiværdier.
Image Courtesy: "Ionization Energy Periodic Table" af Cdang og Adrignola. (CC BY-SA 3. 0) via Wikimedia Commons