Forskel mellem geometriske isomerer og strukturelle isomerer
Geometriske isomerer vs strukturelle isomerer
Isomerer er forskellige forbindelser med samme molekylære formel. Der er forskellige typer af isomerer. Isomerer kan hovedsageligt opdeles i to grupper som konstitutionelle isomerer og stereoisomerer. Konstitutionelle isomerer er isomerer, hvor tilstedeværelsen af atomer adskiller sig i molekyler. I stereoisomerer forbindes atomer i samme sekvens, i modsætning til forfatningsmæssige isomerer. Stereoisomerer er kun forskellige i arrangementet af deres atomer i rummet. Stereoisomerer kan være af to typer, enantiomerer og diastereomerer. Diastereomerer er stereoisomerer, hvis molekyler ikke er spejle billeder af hinanden. Enantiomerer er stereoisomerer, hvis molekyler er ikke-spændbare spejlbilleder af hinanden. Enantiomerer forekommer kun med chirale molekyler. Et chiralt molekyle defineres som et, der ikke er identisk med dets spejlbillede. Derfor er det chirale molekyle og dets spejlbillede enantiomerer af hinanden. For eksempel er 2-butanolmolekyle chiralt, og det og dets spejlbilleder er enantiomerer.
Geometriske isomerer
Geometriske isomerer er en type stereoisomerer. Denne type isomerer resulterer, når molekyler har en begrænset rotation, i grund og grund på grund af en dobbeltbinding. Når der er en enkelt carbon-carbon-binding, er rotationen mulig. Derfor trækker vi altså atomerne, deres arrangement bliver det samme. Men når der er en carbon-carbon dobbeltbinding, kan vi tegne to arrangementer af atomer i et molekyle. De resulterende isomerer er kendt som cis-, trans-isomerer eller E-Z-isomerer. I cis-isomer er de samme typer af atomer i samme side af molekylet. Men i trans isomer er de samme typer af atomer i modsat side af molekylet. For eksempel er cis- og transstrukturerne for 1,2-dichlorethan som følger.
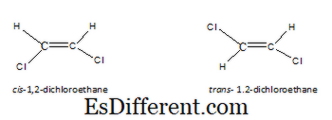
For et molekyle at have geometriske isomerer er det ikke kun tilstrækkeligt at have en dobbeltbinding alene. De to atomer eller grupper knyttet til den ene ende af dobbeltbindingen skal være forskellige. Følgende molekyler har for eksempel ikke geometriske isomerer, begge atomer i venstre ende er hydrogener. På grund af det, hvis vi trækker det i enten cis eller trans, er begge molekyler de samme.

Men det er ligegyldigt, om de fire tilknyttede grupper eller atomer er forskellige. I den anledning kan vi navngive dem som E eller Z.
Strukturelle isomerer
Disse er også kendt som forfatningsmæssige isomerer. Konstitutionelle isomerer er isomerer, hvor tilslutningen af atomer adskiller sig i molekyler. Butan er den enkleste alkan til at vise konstitutionel isomerisme. Butan har to forfatningsmæssige isomerer, butan selv og isobuten.

Da deres forbindelser er forskellige, har to molekyler forskellige fysiske og kemiske egenskaber.Strukturelle isomerer kan dannes af carbonhydrider, hvor de har mindst fire carbonatomer. Der er tre typer af strukturelle isomerer som skelet-, positions- og funktionelle gruppisomerer. I skelet-isomerien, som angivet i ovenstående eksempel, omlejres skelettet for at give forskellige isomerer. I position isomerer ændrer en funktionel gruppe eller en anden gruppe stilling. I funktionelle gruppeisomerer, skønt de har samme formel, er molekylerne forskellige til at have forskellige funktionelle grupper.
|
Hvad er forskellen mellem Geometriske Isomerer og Strukturelle Isomerer ? • Geometriske isomerer er stereoisomerer. Derfor er forbindelserne også ens i forhold til strukturelle isomerer, hvor isomerer adskiller sig på grund af atomer 'forbindelser. I geometriske isomerer er de forskellige på grund af det tredimensionelle arrangement i rummet. • Ofte for et molekyle er der to geometriske isomerer som cis, trans eller E, Z, men for et molekyle kan der være et stort antal strukturelle isomerer. • Geometrisk isomerisme er grundlæggende vist ved molekyle med carbon-carbon-dobbeltbindinger. Strukturel isomerisme er også vist ved alkaner, alkener, alkyner og aromatiske forbindelser. |




