Forskel mellem metan og ethan | Methan vs Ethane
Nøgleforskel - Metan vs Ethane
Metan og Ethan er de mindste medlemmer af alkanfamilien. De molekylære formler af disse to organiske forbindelser er henholdsvis CH 4 og C 2 H 6 . nøgleforskel mellem methan og ethan er deres kemiske struktur ; et ethanmolekyle kan betragtes som to methylgrupper, der tilsluttes som en dimer af methylgrupper. De andre kemiske og fysiske forskelle opstår primært på grund af denne strukturelle forskel.
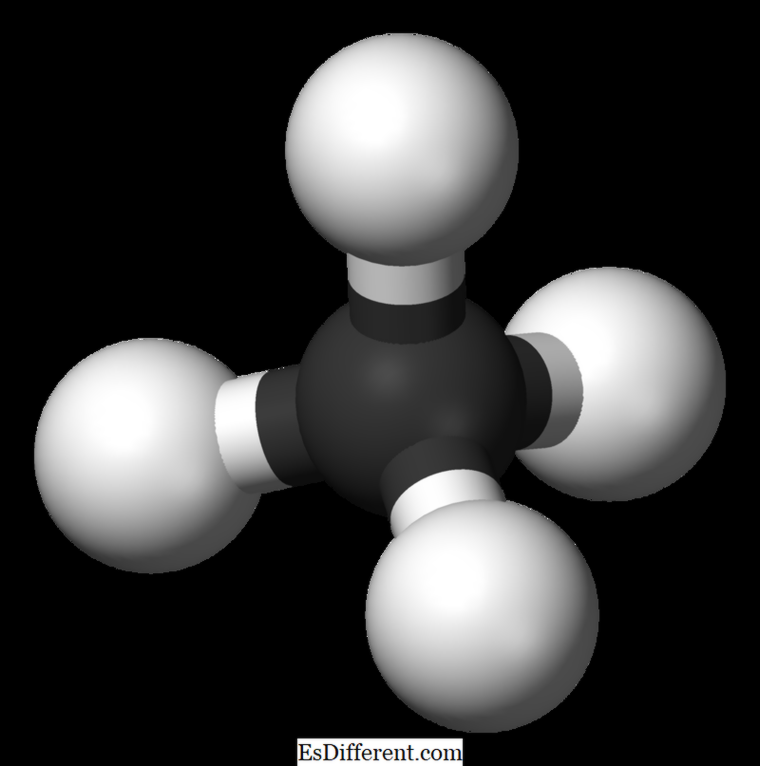
Hvad er metan?Metan er det mindste medlem af alkanfamilien med den kemiske formel CH
4 (fire hydrogenatomer er bundet til et carbonatom). Det anses for at være den vigtigste komponent i naturgas. Metan er en farveløs, lugtfri og smagløs gas; også kendt som carbane, mose gas, naturgas, carbontetrahydrid, og hydrogencarbid . Det kan let antændes, og dampen er lettere end luften.
3 - med vand i atmosfæren. Hvad er Ethan?
Ethan er en farveløs, lugtfri gasformig forbindelse ved standard temperatur og tryk. Dens molekylære formel og molekylvægt er henholdsvis C
2 H 6 og 30,7 g · mol -1 . Det er isoleret fra naturgas, som et biprodukt fra petroleumsraffinering. Ethan er meget vigtigt i ethylenproduktionen.

Karakteristik af methan og ethan
Struktur:
Metan:
Den molekylære formel af methan er CH 4, og det er et eksempel af et tetrahedralt molekyle med fire ækvivalente CH-bindinger (sigma-bindinger). Forbindelsesvinkel mellem H-C-H-atomer er 109. 5 0 , og alle C-H-bindinger er ækvivalente, og den er lig med108. 70 pm. Ethan: Den molekylære formel af ethan er

C 2 H 6, og det er et mættet carbonhydrid, da det ikke indeholder flere obligationer. Kemiske egenskaber: Metan: Stabilitet: Metan er et kemisk meget stabilt molekyle, som ikke reagerer med KMnO

4
, K
2 Cr < 2 O 7 , H 2 SO 4 eller HNO 3 under normale forhold. Forbrænding: Ved tilstedeværelse af overskydende luft eller ilt forbrænder metan med en lyseblå, ikke-lysende flammeproducerende carbondioxid og vand.Det er en meget eksoterm reaktion; Derfor bruges den som et fremragende brændstof. I tilstedeværelse af utilstrækkelig luft eller ilt brænder den delvist i kulilte (CO) gas. Substitutionsreaktioner: Methan viser substitutionsreaktioner med halogener. I disse reaktioner erstattes et eller flere hydrogenatomer med et lige antal halogenatomer, og det kaldes "halogenering". "Det reagerer med klor (Cl) og brom (Br) i nærværelse af sollys. Reaktion med damp:
Når en blanding af methan og damp ledes gennem et opvarmet (1000 K) nikkel understøttet på aluminiumoxidoverflade, kan det producere hydrogen. Pyrolyse:
Når metan opvarmes til ca. 1300 K, bliver den dekomponeret til carbon black og hydrogen. Ethan:
Reaktioner: Ethan gas (CH 3
CH 3 ) reagerer med bromndamp i nærværelse af lys til dannelse af bromethan, (CH 3
CH
2 Br) og hydrogenbromid (HBr). Det er en substitutionsreaktion; et hydrogenatom i ethan er substitueret med bromatom. CH 3 CH 3 + Br 2 à CH 3
CH 2 Br + HBr Forbrænding: Den fuldstændige forbrænding af ethan producerer 1559. 7 kJ / mol (51,9 kJ / g) varme, kuldioxid og vand. 2 2 H 6 + 7 O 2
→ 4 CO
2 + 6 H 2 O + 3120 kJ Det kan også forekomme uden overskud af ilt, der frembringer en blanding af amorft carbon og carbonmonoxid. 2 C 2 H 6 + 3 O 2 → 4 C + 6 H
2
O + energi 2 C 2 H 6 + 5 O 2 → 4 CO + 6 H 2
O + energi 2 C 2 H 6 + 4 O 2 → 2 C + 2 CO + 6 H 2
O + energi mv. Definitioner: Substitutionsreaktioner: Substitutionsreaktion er en kemisk reaktion, der involverer forskydning af en funktionel gruppe i en kemisk forbindelse og erstattet det ved en anden funktionel gruppe. Anvendelser: Metan: Metan anvendes i mange industrielle kemiske processer (som brændsel, naturgas, flydende naturgas) og transporteres som kølevæske. Ethan: Ethan bruges som brændstof til motorer og som kølemiddel til et ekstremt lavtemperatur system. Den leveres i stålcylindre som en flydende gas under eget damptryk. Referencer: "Ethane".
Wikipedia
. N. p., 2016. Web. 7. juni 2016. Khanna, Bhishm. "Hvad er de kemiske egenskaber ved methan? ”. Preservearticles. dk. N. p., 2016. Web. 7. juni 2016. "Methan | CH4 - Pubchem ".
pubchem. NCBI. NLM. NIH. gov
. N. p., 2016. Web. 7. juni 2016. "Metan". Wikipedia
. N. p., 2016. Web. 7. juni 2016. Image Courtesy: "Ball-and-stick model of methane molecule" af (Public Domain) via Commons Wikimedia "Ball-and-stick model of ethane molecule" og Ben Mills - eget arbejde (Public Domain) via Commons Wikimedia "Metan" Af Jynto - eget arbejde baseret på fil: metan-CRC-MW-dimensioner-2D.png, (Public Domain) via Commons Wikimedia "Ethane" (Public Domain) via Commons Wikimedia




