Forskel mellem monatomisk og diatomisk | Monatomisk vs Diatomisk
Forskel mellem monatomisk og diatomisk er primært med hensyn til de atomer, der er til stede i arten. Som navne antyder, står begge disse termer for forskellige stater af atomforeninger, hvor 'mono' betyder 'en' og 'di' betyder 'to'. 'Derfor betyder simpelthen monatomisk et'
et atom 'og diatomisk betyder' to atomer. ' Der kan dog være så mange forskellige variationer i denne grundlæggende definition.
Hvad er monatomisk?Når
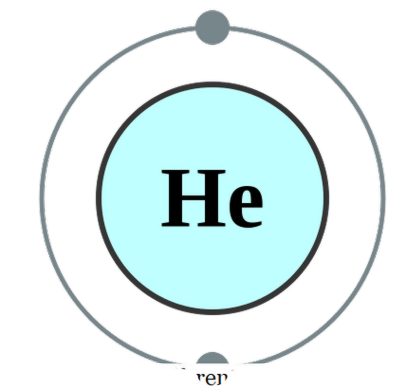
eksisterer et enkelt atom på egen hånd (som sjældent er tilfældet), kalder vi det monatomisk. Det betyder, at elementerne er i deres rene singulære form. Det eneste praktiske eksempel, der kan komme under denne kategori, ville være de ædle gasser, der eksisterer som atomer alene, da de har deres ydre skal færdiggjort med en oktet af elektroner. Derfor ser de ikke ud til at acceptere eller donere flere elektroner for at være mere stabile. Derfor er ædle gasser stabile i monatomisk form. Nogle eksempler er; He - Helium, Ne - Neon, Ar - Argon, Xe - Xenon, Kr - Krypton, Rn - Radon.
Hvad er diatomisk?
Når
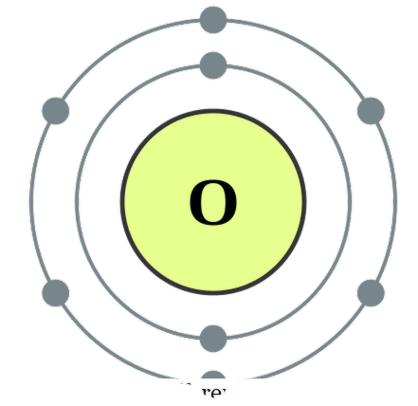
to atomer er i forbindelse med hinanden , kalder vi det diatomisk. Disse atomer kan være af samme type eller forskellige. Når de er to lignende atomer i forening, kalder vi det ' homonukleære diatomer ', og hvis de er lavet af forskellige typer, kalder vi det ' heteronukleære diatomer '. Eksempler på nogle homonukleære diatomer ville være O2, N2, H2 osv., Mens CO, NO, HCI, etc. kan gives som eksempler på heteronukleære diatomer. Oxygen
Diatomer kan betragtes som forbindelser, når de danner disse foreninger for at opnå mere stabilitet ved at dele elektroner med hinanden, så begge atomer opnår edelgase elektronisk konfiguration. De kan binde gennem kovalente bindinger ved overlapning af atomorbitaler, ellers kan de danne ioniske bindinger blandt dem, som er en attraktionskraft mellem en positivt ladet art og en negativt ladet art. Eksempler på kovalente bindinger blandt diatomer indbefatter CO, NO, etc., og HCI kan betragtes som en art med ionisk attraktionskarakter. Men som tiltrækningskraften mellem H + og Cl- er ikke særlig stærk, er det ikke et meget godt eksempel på ionbindinger, der er et andet defineret emne.
Hvad er forskellen mellem monatomisk og diatomisk?
• Monatomiske arter har et atom, mens diatomiske arter har to atomer.
• Monatomiske arter er generelt ikke stabile, men diatomiske arter er generelt stabile.
• Ædelgasser er kun monatomiske og findes ikke i diatomisk form.
• Der findes kemiske bindinger mellem diatomiske arter, mens der ikke er bindinger i monatomiske arter.
Billeder Courtesy:
Helium elektronkonfiguration af Pumbaa (CC BY-SA 2. 0 uk)
- Oxygen elektronkonfiguration af DePiep (CC BY-SA 3. 0)




