Forskel mellem oktet og duplet | Octet vs Duplet
Nøgleforskel - Octet vs Duplet
Der er kemisk aktive og inaktive atomer eller forbindelser til stede i naturen. Denne egenskab er hovedsagelig afhængig af antallet af elektroner, der er til stede i atomernes yderste skaller. Atomer med ufuldstændige skaller kan blive aktive for at fuldføre deres elektronkonfiguration for at blive stabile. Atomer, der er inaktive, har en komplet elektronkonfiguration; således reagerer disse atomer ikke med noget andet atom, medmindre de er under særlige forhold. Ædle gasser er altid inaktive i naturen. Derfor er de kendt som inerte gasser. Inerte gasser er i den ottende kolonne i det periodiske bord. Andre elementer i samme periode (række) har tendens til at opnå elektronkonfigurationen af den inerte gas i slutningen af denne periode, hvilket er den mest stabile form i naturen. Aktive atomer har en tendens til at afslutte antallet af elektroner i henhold til oktetregel eller dobbeltregulering . Nøgleforskellen mellem oktet og dublet er, at octet er et atom eller en ion med maksimalt otte elektroner i den yderste shell , mens duplet er et atom med maksimalt to elektroner i den yderste skal.
INDHOLD
1. Oversigt og nøgleforskel
2. Hvad er en Octet
3. Hvad er en Duplet
4. Side ved side sammenligning - Octet vs Duplet
5. Sammendrag
Hvad er en Octet?
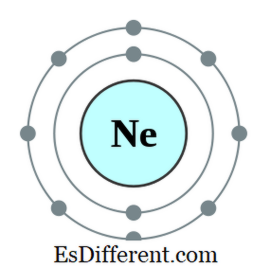
En octet er et atom eller en ion med otte elektroner i den yderste skal af det pågældende atom. Alle ædle gasser undtagen helium har otte elektroner og er inerte i naturen. Elektronkonfigurationen af en ædelgas vil altid ende som følger.
N22 np 6 Eksempelvis er elektronkonfigurationen af Neon 1s
2 2s 2 2p 6 . Neon er en inert gas. Andre elementer med syv, seks osv. Elektroner i det yderste kredsløb har tendens til at adlyde oktetregel ved at opnå elektroner udefra; nogle andre elementer med en, to osv. elektroner har en tendens til at miste elektroner og opnå elektronkonfigurationen af den nærmeste inerte gas. Men andre elementer i midten af det periodiske bord vil danne nye bindinger med elementer, der har overskydende elektroner til at dele disse elektroner og blive en oktet.
Hvad er en Duplet?
Hydrogenatom og heliumatom er de mindste elementer i naturen og har kun en omkreds omkring deres kerne. Denne kredsløb kaldes 1s orbital. Denne kredsløb kan indeholde maksimalt to elektroner. Hydrogenatom har en elektron, og helium har to elektroner. Derfor kaldes helium en dublet.Helium har det maksimale antal elektroner, det kan have; således er det et stabilt element i naturen. Derfor er Helium også en inert gas. Men hydrogen har kun en elektron, og den eneste kredsløb, den har, er ufuldstændig. Således er alene hydrogenatom meget reaktivt, og det har tendens til at danne en kovalent binding med et andet hydrogenatom ved at dele de eneste elektroner, de har. Derefter bliver disse hydrogenatomer dubletter, da de nu har to elektroner i deres yderste orbitaler. Men lithium kan også opføre sig som en duplik ved at fjerne elektronen fra dets yderste omløb. Lithiums elektronkonfiguration er 1s
2 2s 1 . Ved at fjerne 2s 1 elektronen, kan det blive en duplikat. I så fald er han, H - og Li + dubletter, der kan eksistere som stabile dubletter. Alle dubletter har elektronkonfiguration som følger.
ns
2 Figur 02: Helium, en dublet

Hvad er forskellen mellem Octet og Duplet?
- diff Artikel Mellem før Tabel ->
Octet vs Duplet
Octet har otte elektroner i den yderste skal. |
|
| Duplet har to elektroner i den yderste skal. | Fælles elektronkonfiguration |
| Octet har ns | |
| 2 np 6 type elektronkonfiguration i slutningen. Duplet har ns | 2 typekonfiguration i slutningen. Antal orbitaler |
| Octet kan have mindst to orbitaler. | |
| En duplikat har kun en orbital. | Type orbitaler |
| En oktet kan have alle typer orbitaler som s, p, d, f, etc. | |
| Duplet har kun s orbitalt. | Sammendrag - Octet vs Duplet |
Alle elementer har tendens til at blive stabile. Men med ufuldstændige elektronkonfigurationer kan atomer ikke være stabile; således bliver de meget reaktive for at fylde skallerne med elektroner ved at vinde, tabe eller dele elektroner. Atomer eller molekyler, der overholder oktet- eller dupletreglen, er stabile. Nøgleforskellen mellem oktet og dublet er, at oktet har otte elektroner i sin yderste omgang, mens duplikat har to elektroner i sin omgang.
Referencer:
1. Nema, P., 2011. Topperlearning. [Online] Tilgængelig på: // www. topperlearning. com / forums / home-work-help-19 / what-is-octet-duplet-valency-and-ions-chemistry-structure-of-the-atom-46317 / reply [Tilgængelig 29 05 2017].
2. Chang, R., 2010. Kemi. 10. udgave. New York: McGraw-Hill.
3. Anon., 2015. Grade stacker. [Online] Tilgængelig på: // gradestack. com / NTSE-Complete-Course / Chemical-Bonding / Chemical-Activity-of-An / 19176-3853-37737-studie-wtw [Tilgængelig 29 05 2017].
Image Courtesy:
1. "Electron shell 002 Helium - no label" Af Pumbaa (originalt arbejde af Greg Robson) - Elektronisk skaldiagrammer (tilsvarende mærket version) (CC BY-SA 2. 0 uk) via Commons Wikimedia
2. "Electron shell 010 Neon" Af Pumbaa (originalværk af Greg Robson) (CC BY-SA 2. 0 uk) via Commons Wikimedia




