Forskel mellem phenyl og benzyl | Phenyl vs benzyl
phenyl vs benzyl
Både phenyl og benzyl er afledt af benzen, og forveksles ofte af kemiske studerende. Phenyl er et carbonhydridmolekyle med formlen C 6 H 5 , hvorimod benzyl er C 6 H 5 CH 2 <; en ekstra CH 2 gruppe bundet til benzenringen. Phenyl
Phenyl er et carbonhydridmolekyle med formlen C

H 5 . Dette er afledt af benzen, derfor har lignende egenskaber som benzen. Dette adskiller imidlertid sig fra benzen på grund af mangel på et hydrogenatom i et kulstof. Så molekylvægten af phenyl er 77 g mol -1 . Phenyl forkortes som Ph. Normalt er phenyl bundet til en anden phenylgruppe, atom eller molekyle (denne del er kendt som substituenten, R-gruppen som i figuren). Filternes carbonatomer er sp2 hybridiseret som i benzen. Alle carbonerne kan danne tre sigma-bindinger. To af sigma-bindingerne er dannet med to tilstødende carboner, således at det vil give anledning til en ringstruktur. Den anden sigma-binding er dannet med et hydrogenatom. Imidlertid dannes i et carbonatom i ringen den tredje sigmabinding med et andet atom eller molekyle snarere end et hydrogenatom. Elektronerne i p-orbitaler overlapper hinanden for at danne den delokaliserede elektronmoln. Derfor har phenyl lignende C-C bindingslængder mellem alle carboner, uanset om der er skiftevis enkelt- og dobbeltbindinger. Denne C-C bindingslængde er ca. 1. 4 Å. Ringen er plan og har en 120 ° vinkel mellem bindinger omkring et kulstof. På grund af substituentgruppen af phenyl ændres polariteten og andre kemiske eller fysiske egenskaber. Hvis substituenten donerer elektroner til den delokaliserede elektron-skyde af ringen, er de kendt som elektrondonerende grupper (E.g.-OCH 3 , NH 2 ). Hvis substituenten tiltrækker elektroner fra elektronskyen, er den kendt som elektronudtrækkende substituent. (E. g. -NO 2 , -COOH). Phenylgrupper er stabile på grund af deres aromaticitet, så de ikke let undergår oxidationer eller reduktioner. Endvidere er de hydrofobe og ikke-polære. Benzyl Formlen for benzyl er C
6H
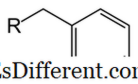
5 CH 2 . Dette er også et derivat af benzen. Sammenlignet med phenyl har benzyl en CH 2 gruppe bundet til benzenringen. En anden molekylær del (R-gruppe som afbildet i billedet) kan bindes til benzylgruppen via binding til CH 2 carbonatomet. Benzylgruppe er forkortet som "Bn". Molekylvægten af benzylgruppen er 91 g mol -1 . Da der er en benzenring, er benzylgruppen aromatisk.I organiske kemiske mekanismer kan benzylgruppen dannes enten som en radikal carbocation (C 6 H 5 CH 2 + ) eller en carboanion (C 6 H 5 CH 2 - ). For eksempel er der i nukleofile substitutionsreaktioner dannet benzylgruppe eller kationmellemprodukt. Der er en højere stabilisering af disse mellemprodukter sammenlignet med alkylradikalet eller kationen. Reaktiviteten af benzylposition svarer til allylpositionen. Benzylgrupper anvendes ofte i organisk kemi som beskyttelsesgrupper, især for at beskytte carboxylsyre- eller alkoholfunktionsgrupper.
H
5 CH < 2 . • Benzyl har ekstra CH 2 gruppe sammenlignet med phenyl. • I phenyl er bensenringen direkte bundet til et substituentmolekyle eller et atom, men i benzyl gør CH 2 gruppen forbindelse med et andet molekyle eller et atom.


