Forskel mellem SYBR Green og Taqman | SYBR Green vs Taqman
Nøgleforskel - SYBR Green vs Taqman
SYBR Green og Taqman er to metoder til at detektere eller se amplifikationsprocessen i realtid PCR. SYBR Green er en metode baseret på interkalering af nukleinsyrefarvningsfarvestof, mens Taqman er en metode baseret på hydrolysesonde. Begge teknologier er designet til at generere fluorescens under PCR, hvilket gør det muligt for realtid PCR at overvåge reaktionen i "realtid". SYBR Green metode udføres under anvendelse af et fluorescerende farvestof kaldet SYBR green og detekterer amplifikationen ved at binde farvestoffet til produceret dobbeltstrenget DNA. Taqman udføres under anvendelse af dobbeltmærkede prober og detekterer amplifikationen ved nedbrydning af proben ved hjælp af Taq-polymerase og frigivelser af fluoroforen. Dette er nøgleforskellen mellem SYBR Green og Taqman.
INDHOLD
1. Oversigt og nøgleforskel
2. Hvad er SYBR Green
3. Hvad er Taqman
4. Sammenligning ved siden af hinanden - SYBR Green vs Taqman
5. Sammendrag
Hvad er SYBR Green?
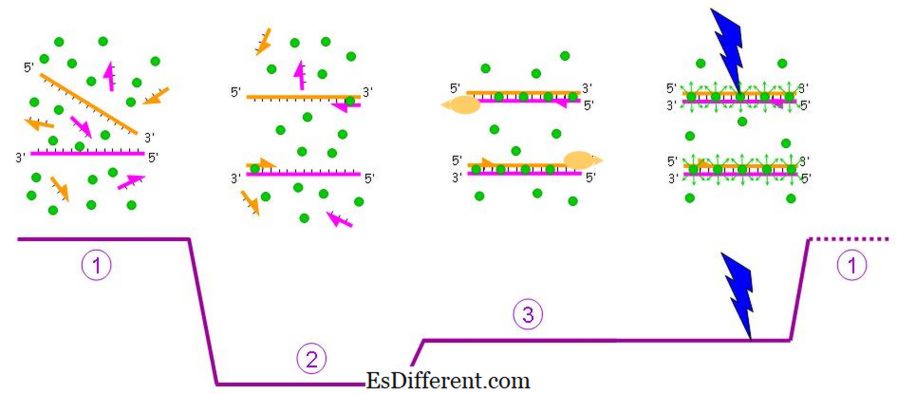
SYBR Green er et fluorescerende farvestof brugt til at plette nukleinsyrer, især dobbeltstrenget DNA i molekylærbiologi. SYBR Green metode bruges til at kvantificere PCR produkter i realtid PCR. Når det er bundet til DNA, absorberer det resulterende DNA-farvestofkompleks blå lys og udsender intens grønt lys. Det sker på grund af den strukturelle ændring, der forekommer i farvestofmolekylet ved binding med dobbeltstrenget DNA. Når PCR skaber mere og mere DNA, binder flere farvestofmolekyler med DNA, hvilket genererer mere fluorescens. Derfor øges fluorescensen med PCR-produktakkumuleringen. Mængden af PCR-produkt kan således måles kvantitativt ved SYBR Green fluorescensdetektering.
SYBR-farvestof kan også bruges til DNA-mærkning i cytometri og fluorescerende mikroskopi. Ethidiumbromid er med succes erstattet af SYBR Green, da ethidiumbromid er et kræftfremkaldende farvestof med bortskaffelsesproblemer under DNA-visualisering i gelelektroforese.
Der er fordele og ulemper ved SYBR-grøn metode. Denne metode er meget følsom, billig og nem at bruge. På grund af dets evne til at binde til et hvilket som helst dobbeltstrenget DNA kan ikke-specifik binding imidlertid føre til over kvantificering af PCR-produkt.
Figur 01: SYBR Green Technique
Hvad er Taqman?
Taqman er en alternativ metode til SYBR Green til at overvåge realtids-PCR-processen. Denne metode afhænger af 5'-3 'exonukleaseaktiviteten af Taq-polymeraseenzym til nedbrydning af proberne under forlængelsen af den nye streng og frigivelse af fluorofor.Dual-mærkede prober anvendes i denne metode, og den er baseret på hydrolyse af prober. Prober er fluorescensmærkede DNA-oligonukleotider, der har et fluorescerende reportermolekyle (fluorofor) ved 5'-enden og et quenchermolekyle ved 3'-enden. De er designet til at binde til den enkeltstrengede skabelon på den modsatte side af primerhalsen. Taq polymerase tilføjer nukleotider til primeren og strækker den nye streng mod de dobbeltmærkede prober. Når først Taq-polymerasen opfylder sonden, aktiveres og nedbrydes exonuklease-virkningen af Taq-polymerasen sonden. Når det er færdiggjort syntesen af den nye streng, udsættes sonden for at fuldføre nedbrydning og frigive fluoroforen. Frigivelsen af fluorofor frembringer fluorescens. Fluorescerende Quencher-molekyle slukker effektivt det udsendte lys og skaber output til kvantificering af PCR-produktet. Frigivelsen af fluoroforer og mængden af PCR-produkterne er proportionelle. Derfor kan kvantificering let foretages ved hjælp af Taqman-metoden.

Figur 02: Taqman Metode
Taqman metode anvendes i realtid PCR, kvantificering af genekspression, påvisning af genetiske polymorfier, kvantificering af chromosomal DNA deletioner, bakteriel identifikation, verifikation af mikroarray analyse, SNP genotyping mv. Hvad er forskellen mellem SYBR green og Taqman?
- diff Artikel Mellem før tabel ->
SYBR Green vs Taqman
SYBR Green er baseret på DNA-bindende farvestof.
|
|
| Taqman afhænger af hybridiseringsprober og 5 'til 3' exonukleaseaktivitet af Taq-polymerase. | Fluorescensmærkede prober |
| Ingen fluorescensmærkede prober er ikke påkrævet. | |
| Dobbelmærkede prober er påkrævet. | Multiplexgenanalyse |
| Den kan ikke bruges til multiplexgenmål. | |
| Den kan bruges til multiplexgenmål. | Omkostninger |
| Dette er billigere. | |
| Dette er dyrere. | Specificitet |
| Dette er mindre specifikt og binder med ethvert dobbeltstreng DNA | |
| Disse er yderst specifikke, da prober detekterer de specifikke amplifikationsprodukter. | Effektivitet |
| Dette er mindre effektivt. | |
| Dette er meget effektivt. | Anvendelse |
| Dette bruges i realtid PCR, agarosegelvisualisering, DNA-mærkning mv. | |
| Dette anvendes i realtids-PCR, kvantificering af genekspression, påvisning af genetiske polymorfier mv. | Sammenfatning - SYBR Green og Taqman |
Taqman og SYBR green er to metoder anvendt i realtid PCR (kvantitativ PCR). Begge metoder gør det muligt at kvantificere PCR-produktet effektivt og stole på emissionen af fluorescensen. Taqman-metoden anvender dobbeltmærkede prober til påvisning af det akkumulerede DNA, mens SYBR Green-metoden anvender et fluorescerende farvestof. Begge disse metoder har også forskellige anvendelser inden for molekylærbiologi.
Reference:
1. Tajadini, Mohamad Hasan, Mojtaba Panjehpour og Shaghayegh Haghjooy Javanmard. "Sammenligning af SYBR Green og TaqMan metoder i kvantitativ real-time polymerase kædereaktion analyse af fire adenosin receptor subtypes."Avanceret biomedicinsk forskning. Medknow Publications & Media Pvt Ltd, 2014. Web. 13. marts 2017.
2. "Real-time PCR grundlæggende principper. "Real Time PCR, Quantitative (qPCR), Primers & Mastermix: Primerdesign Ltd. N. p., n. d. Web. 13. marts 2017.
3. "SYBR Green og Other Real-Time PCR Dyes. "Biocompare. N. p., 5. april 2010. Web. 14. marts 2017
Billede Courtesy:
1. "PCR med SYBR green" Af -Ygonaar 23: 09, 7 marts 2006 (UTC) - Det er en graf, der oprettes af Ygonaar med Power Point, CC BY-SA 3. 0, // commons. Wikimedia. org / w / indeks. php? curid = 619.528
2. "Taqman" Af Bruger: Braindamaged - Egent arbejde (Public Domain) via Commons Wikimedia




