Forskel mellem valency og valence electrons | Valence vs Valence Electrons
Nøgleforskelle - Valens vs Valenselektroner
Valenselektroner og valenceelektroner er interrelaterede udtryk, og nøgleforskel mellem valens og valenselektroner er bedst forklaret i deres definitioner; valenselektroner er elektronerne i den yderste skal af et element mens valenselektroner er antallet af elektroner, som skal accepteres eller fjernes for at opnå den nærmeste edelgaskonfiguration. Det er elektronerne i den yderste skal, som normalt bidrager til at danne kemiske bindinger. I nogle atomer er antallet af valenselektroner lig med antallet af valenselektroner.
Hvad er Valence-elektroner? Antallet af elektroner i det yderste skal af et atom kaldes "valenselektroner". På grund af denne grund kaldes den yderste skal af et atom "valence shell". Det meste af tiden er disse elektroner, der deltager i kemisk binding. Når elementer danner kationer fjerner de elektroner fra valensskallen. Antallet af valenselektroner i et element bestemmer gruppen i det periodiske bord.

Antallet af elektroner, der kræves for at opnå eller tabe for at fylde den yderste skal af et atom kaldes "valenselektroner". For et bestemt atom afhænger antallet af valenselektroner af antallet af valenselektron i atomet. For Sodium er valensen lig med 1, fordi den fjerner den sidste elektron i den yderste skal for at opnå en oktetstruktur af den nærmeste ædelgas.
|
Definition af valens og valenselektroner
Valenselektroner:
Elektronerne i det yderste skal af et atom kaldes "valenselektroner". For "s" og "p" gruppeelementer er antallet af valenselektroner lig med deres gruppens nummer. Eksempel
Valenselektroner:
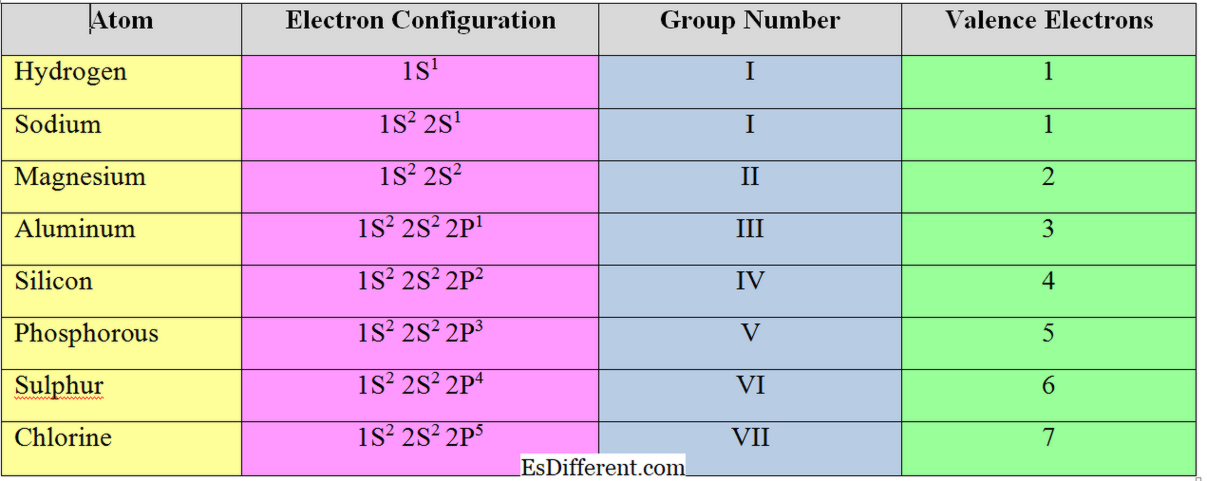
Antallet af elektroner, der skal accepteres eller fjernes for at opnå den elektroniske konfiguration af den nærmeste ædelgas, kaldes "valenselektroner" eller "valensen" af et atom. Generelt for metalelementer (elementer i gruppe I, II og III) er antallet af valenselektroner lig med antallet af valenselektroner; de fjerner elektronerne i valensskallen for at opnå oktetstrukturen.
Men ikke-metalelementer accepterer elektroner for at opnå elektronkonfigurationen af den nærmeste ædelgas. Derfor beregnes valensen af ikke-metalelementer ved at subtrahere de totale valenceelektroner fra 8.
For chlor, Antal valenselektroner = 8-7 = 1
Karakteristik af Valens og Valenselektroner

Valens og Valenselektroner af gruppe VIII-elementer
Valenselektroner:
Gruppe VIII-elementer er de ædle gasser, og de er kemisk stabile. Deres ydre skal er komplet, og den indeholder otte elektroner i den yderste skal (undtagen Helium -He); således at gruppe VIII-elektroner har otte valenselektroner. Valenselektroner:
Valens er et mål for evnen til at danne bindinger med andre elementer eller molekyler. Ædelgasser accepterer eller fjerner ikke elektroner for at opnå oktetreglen, da de allerede har gennemført den sidste skal. Derfor er valensen af gruppe VII elementer lig med nul. Image Courtesy:
"Elektronskal 010 Neon - ingen etiket" ved commons: Bruger: Pumbaa (originalt arbejde med commons: Bruger: Greg Robson) - // commons. Wikimedia. org / wiki / Kategori: Electron_shell_diagrams (tilsvarende mærket version). (CC BY-SA 2. 0 uk) via Commons




