Forskel mellem hydroxyl og hydroxid | Hydroxyl vs Hydroxid
Nøgleforskel - Hydroxyl vs Hydroxid
De to udtryk hydroxyl og hydroxid lyd meget ligner, da begge har to lignende atomer, oxygen (O = 16) og hydrogen (H = 1). Hydroxid er en negativ ion med en enkelt ladning, og hydroxyl findes ikke i sin fri form, den er en del af et andet molekyle eller ion. Hydroxidioner er mere reaktive end hydroxylgruppen i et molekyle. Dette er nøgleforskellen mellem hydroxyl og hydroxid.
Hvad er Hydroxyl?
Hydroxyl er en neutral forbindelse, og den er den tilsvarende elektrisk neutrale forbindelse af hydroxidion. Den frie form af hydroxyl (• HO) er en radikal, og når den er bundet covalent til andre molekyler, betegnes den som hydroxyl (-OH) -gruppen. Hydroxylgrupper kan virke som nukleofiler, og hydroxylradikal anvendes som katalysator i organisk kemi. Hydroxylgrupper er ikke stærkt reaktive som de andre nukleofiler. Imidlertid er de facilitatorer i dannelsen af stærke intramolekylære kræfter kaldet "hydrogenbindinger".

Hvad er Hydroxid?
Hydroxid er en diatomisk anion, der indeholder et oxygenatom og et hydrogenatom. Bindingen mellem oxygen og hydrogenatom er kovalent, og dens kemiske formel er OH - . Selvionisering af vand producerer hydroxylioner, og derfor er hydroxylioner en naturlig del i vandet. Hydroxidioner anvendes som en base, en ligand, en nukleofil og en katalysator i kemiske reaktioner. Derudover producerer hydrogenioner salte med metalkationer, og de fleste dissocieres i vandige opløsninger og frigiver solvatiserede hydroxidioner. Mange uorganiske kemiske stoffer indeholder udtrykket "hydroxid" i deres navn, men de er ikke ioniske, og de er kovalente forbindelser, der indeholder hydroxylgrupper.

Hvad er forskellen mellem Hydroxyl og Hydroxid?
Struktur:
Hydroxyl: Hydroxyl er en elektrisk neutral forbindelse, som kan findes på to måder, som den radikale og den kovalent bundne form.

Hydroxylradikal Når det er kovalent bundet til et molekyle
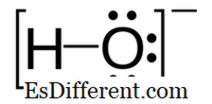
Hydroxid: Hydroxid er en negativt ladet ion, og den negative ladning er på oxygenatomet.
Hydroxyl: Hydroxylgrupper findes i mange organiske forbindelser; alkoholer, carboxylsyrer og hydroxylgrupper indeholdende sukker. Forbindelser indeholdende hydroxylgrupper, såsom vand, alkoholer og carboxylsyrer kan let deprotoneres.Derudover er disse hydroxylgrupper involveret i dannelsen af hydrogenbindinger. Hydrogenbindinger hjælper molekyler til at holde sammen, og dette fører til besiddelse af højere kogende og smeltepunkter. Generelt er organiske forbindelser dårligt vandopløselige; disse molekyler bliver lidt vandopløselige, når de indeholder to eller flere hydroxylgrupper.
Hydroxid: De fleste kemikalier, der indeholder hydroxid, betragtes som meget ætsende, og nogle er meget skadelige. Når disse kemikalier opløses i vand, fungerer hydroxidionen som en utrolig stærk base. Da hydroxidion bærer en negativ ladning, bindes den ofte til positivt ladede ioner.
Nogle ioniske forbindelser indeholdende hydroxidgrupper i deres molekyle opløses rigtig godt i vand; ætsende baser som natriumhydroxid (NaOH) og kaliumhydroxid (KOH) kan tages som eksempler. Imidlertid er nogle andre hydroxidholdige ionforbindelser lidt uopløselige i vand; Eksempler er kobber (II) hydroxid [Cu (OH) 2 - lyseblå farvet] og jern (II) hydroxid [Fe (OH) 2 - brun].
Reaktivitet:
Hydroxyl : Hydroxylgrupper er mindre reaktive sammenlignet med hydroxidgruppen. Men hydroxylgrupper danner let hydrogenbindinger og bidrager til at gøre molekyler mere opløselige i vand.
Hydroxylradikaler er imidlertid meget reaktive og meget nyttige i organiske kemiske reaktioner.
Hydroxid: Hydroxid (OH - ) -gruppen betragtes som en stærk nukleofil i organisk kemi.
Referencer: Martin. Chaplin @ btinternet. com, M.C. (n. d.). Hydroxidioner. Hentet den 28. december 2016, herfraHydroxidion: Definition & Formel - Video & Lektionstransskription. (n. d.). Hentet den 28. december 2016, herfra Hydroxid. (n. d.). Hentet den 28. december 2016, herfraHydroxygruppe. (n. d.). Hentet den 28. december 2016, herfra Hydroxyl Group: Definition, Structure & Formula. (n. d.). Hentet den 28. december 2016, herfra H. (2014). Hvad er en hydroxylgruppe? Hentet den 28. december 2016, herfra


