Forskel mellem ioniske og kovalente forbindelser | Joniske vs kovalente forbindelser
nøgleforskel - ioniske vs kovalente forbindelser
Mange forskelle kan noteres mellem ioniske og kovalente forbindelser baseret på deres makroskopiske egenskaber, såsom opløselighed i vand, elektrisk ledningsevne, smeltepunkter og kogepunkter. Hovedårsagen til disse forskelle er forskellen i deres bindingsmønster. Derfor kan deres bindingsmønster betragtes som nøgleforskellen mellem ioniske og kovalente forbindelser. (Difference mellem ioniske og kovalente bindinger) Når ioniske bindinger dannes, doneres elektron (er) af et metal, og doneret elektron (er) accepteres af et ikke-metal. De danner en stærk binding på grund af den elektrostatiske attraktion. Kovalente bindinger dannes mellem to ikke-metaller. Ved kovalent binding deler to eller flere atomer elektroner for at tilfredsstille oktetreglen. I almindelighed er ionbindinger stærkere end kovalente bindinger. Dette fører til forskellene i deres fysiske egenskaber.
Hvad er ioniske forbindelser?
Joniske bindinger dannes, når to atomer har en stor forskel i deres elektronegativitetsværdier. I processen med binding af dannelse vinder de mindre elektronegative atom-elektroner og flere elektronegative atomer disse elektroner. Derfor er de resulterende arter modsat ladede ioner, og de danner en binding på grund af den stærke elektrostatiske attraktion.
Joniske bindinger dannes mellem metaller og ikke-metaller. Generelt har metaller ikke mange valenceelektroner i den yderste skal; Imidlertid har ikke-metaller tættere på otte elektroner i valensskallen. Derfor har ikke-metaller tendens til at acceptere elektroner for at tilfredsstille oktetreglen.
Eksempel på ionforbindelse er Na + + Cl - NaCl Natrium (metal) har kun en valenselektron og chlor (ikke-metal) syv valenselektroner.

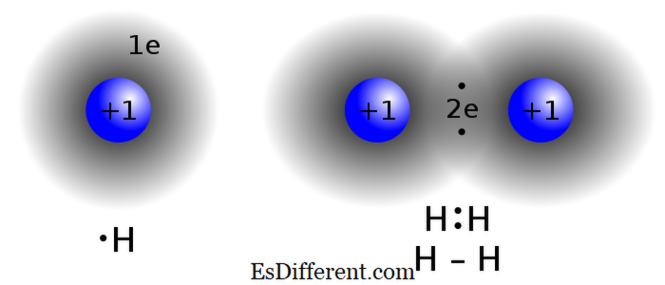
Kovalente forbindelser dannes ved at dele elektroner mellem to eller flere atomer for at tilfredsstille "oktetreglen". Denne bindingstype findes almindeligvis i ikke-metalforbindelser, atomer af den samme forbindelse eller nærliggende elementer i det periodiske bord. To atomer med næsten samme elektronegativitetsværdier udveksler ikke (donere / modtage) elektroner fra deres valensskal. I stedet deler de elektroner for at opnå oktetkonfiguration.
Eksempler på kovalente forbindelser
er methan (CH 4 ), carbonmonoxid (CO), jodmonobromid (IBr) kovalent binding Hvad er forskellen mellem ionisk og kovalent Forbindelser?
Definition af ioniske forbindelser og kovalente forbindelser
Jonisk forbindelse:
Jonisk forbindelse er en kemisk forbindelse af kationer og anioner, der holdes sammen af ionbindinger i en gitterstruktur.
Kovalent forbindelse: Kovalent forbindelse er en kemisk binding dannet ved delingen af en eller flere elektroner, især par af elektroner, mellem atomer.
Egenskaber af ioniske og kovalente forbindelser Fysiske egenskaber
Ioniske forbindelser:
Alle ioniske forbindelser eksisterer som faste stoffer ved stuetemperatur.
Joniske forbindelser har en stabil krystalstruktur. Derfor har de højere smeltepunkter og kogepunkter. Tiltrækningskraften mellem positive og negative ioner er meget stærk.
- diff Artikel Midter før tabel ->
Jonic sammensætning
Udseende| Smeltepunkt | NaCl - Natriumchlorid | Hvidt krystallinsk faststof |
| 801 ° C | KCl - Kaliumchlorid | Hvidt eller farveløst krystallinsk faststof |
| 770 ° C | MgCl | 2 |
| - Magnesiumchlorid Kovalente forbindelser: Kovalente forbindelser findes i alle tre former; som faste stoffer, væsker og gasser ved stuetemperatur. Deres smelte- og kogepunkt er forholdsvis lave sammenlignet med de ioniske forbindelser. | Kovalent forbindelse | Udseende |
Smeltepunkt
HCI-hydrogenchlorid
En farveløs gas
| -114. 2 ° C | CH | 4 |
| -Methan | En farveløs gas | -182 ° C |
| CCl 4 - Carbon tetrachlorid | En farveløs væske < -23 ° C | Ledningsevne |
| Ioniske forbindelser: Fast ioniske forbindelser har ikke fri elektroner; Derfor udfører de ikke elektricitet i fast form. Men når ioniske forbindelser opløses i vand, laver de en opløsning, der fører elektricitet. Med andre ord er vandige opløsninger af ioniske forbindelser gode elektriske ledere. Kovalente forbindelser: | Hverken rene kovalente forbindelser eller opløste former i vand udfører ikke elektricitet. Derfor er kovalente forbindelser dårlige elektriske ledere i alle faser. | Opløselighed |
Joniske forbindelser:
De fleste af de ioniske forbindelser er opløselige i vand, men de er uopløselige i ikke-polære opløsningsmidler. Kovalente forbindelser:
De fleste af de kovalente forbindelser er opløselige i ikke-polære opløsningsmidler, men ikke i vand. Hårdhed
Ioniske forbindelser:
Ioniske faste stoffer er hårdere og sprøde forbindelser. Kovalente forbindelser:
Generelt er kovalente forbindelser blødere end ioniske faste stoffer. Image Courtesy: "Covalent bond hydrogen" af Jacek FH - eget arbejde. (CC BY-SA 3. 0) via Commons "IonicBondingRH11" af Rhannosh - eget arbejde. (CC BY-SA 3. 0) via Wikimedia Commons




