Forskel mellem S og P blokelementer | S vs P Block Elements
Nøgleforskel - S vs. P blokelementer
nøgleforskel mellem s og p blokelementer kan bedst forklares ved hjælp af deres elektroniske konfiguration. I s-blokelementerne fylder den sidste elektron til s-underskallet og i p-blokelementer, fylder den sidste elektron til p-skærmbilledet. Når de danner ioner s blokelementer fjerner deres elektroner fra yderste s delskala nemt, mens p blokelementer accepterer elektroner til p-skærmbilledet eller fjerner elektroner fra p-subshell. Nogle elementer i p-gruppen danner positive ioner, der fjerner elektroner fra den yderste p-subshell, og nogle elementer (de mest elektronegative elementer) danner negative ioner, der accepterer en elektron fra andre. Når du overvejer de kemiske egenskaber, er der en signifikant forskel mellem s og p blokelementer; dette skyldes i grunden elektronkonfigurationen.
Hvad er S-blokelementer?
S-blokelementer er de kemiske elementer i gruppe I og gruppe II i periodisk tabel. Da s underskala kun kan rumme to elektroner, har disse elementer normalt en (gruppe I) eller to (gruppe II) elektroner i den yderste skal. Elementerne i gruppe I og II er vist ovenfor i tabellen.
- diff Artikel Mellem før tabel ->| IA | II A | |
| 2 | Li | Be |
| 3 | Na | Mg |
| 4 | K | Ca |
| 5 | Rb | Sr |
| 6 | Cs | Ba |
| 7 | Fr | Ra |
| IA | Alkalimetaller |
| II A | Alkaliske jordmetaller |
Alle elementerne i s-blok udgør positive ioner, og de er meget reaktive.
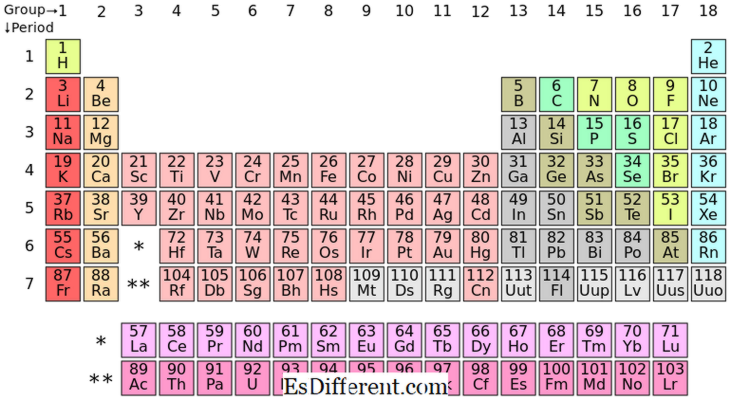
Placeringen af S-blokelementerne i den periodiske tabel
Hvad er P-blokelementer?
P-blokelementer er de elementer, hvis sidste elektron fylder i p-subshell. Der er tre p-orbitaler; hver kredsløb kan rumme to elektroner, hvilket gør i alt seks p-elektroner. Derfor har p-blokelementer en til seks p-elektroner i deres yderste skal. P-blok indeholder både metaller og ikke-metaller; Derudover er der også nogle metalloider.
| 13 | 14 | 15 | 16 | 17 | 18 | |
| 2 | B | C | N | O | F Ne | 3 |
| Al | Si | P | S | Cl | Ar | 4 |
| Ga | Ge | Som | Se | Br | Cr | 5 |
| I | Sn | Sb | Te | I | Xe | 6 |
| Tl | Pb Bi | Po | Ved | Rn | Hvad er forskellen mellem S og P blokelementer? | Almindelig elektronkonfiguration: |
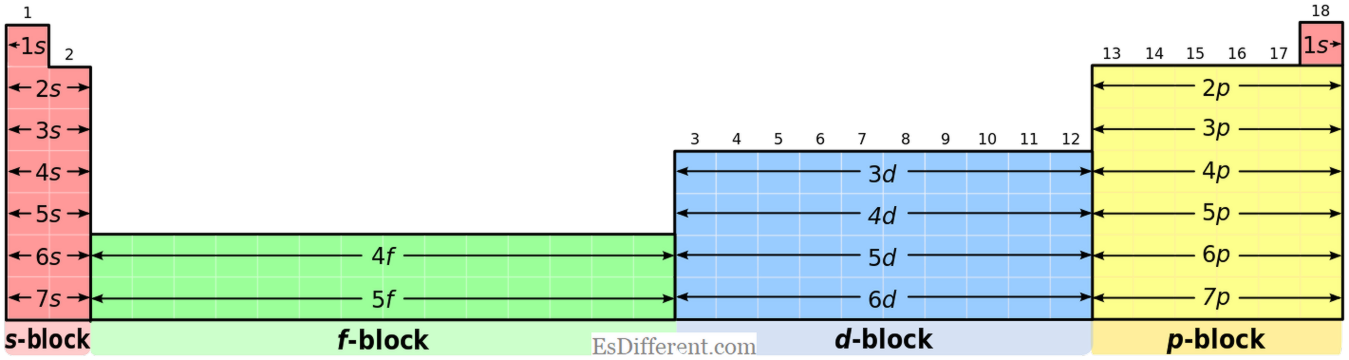
S-blokelementer:
S-blokelementer har den fælles elektronkonfiguration af [ædelgas] ns
1 (for gruppe I-elementer) og [ædelgas] ns 2 (for gruppe II elementer). P-blokelementer: P-blokelementer har den fælles elektronkonfiguration af [ædelgas] ns
2 np 1-6 . Men helium har 1s 2 konfiguration; det er en særlig situation. Oxidationslande: S-blokelementer:
S-blokelementer viser ikke flere oxidationstilstande som p-blokelementer. Eksempelvis viser gruppe I-elementerne +1 oxidationstilstand, og gruppe II-elementer viser +2 oxidationstilstand.
P-blokelementer: I modsætning til s-blokelementerne har p-blokelementer en fælles oxidationstilstand for deres respektive gruppe i det periodiske bord og nogle andre yderligere oxidationstilstande afhængigt af ionets stabilitet.
Gruppe 13
| 14 | 15 | 16 | 17 | 18 | Generel elektronkonfiguration | ns |
| 2 | np 1 ns 2 | np 2 ns 2 | np 3 ns 2 | np 4 ns 2 np | 5 ns 2 np | 6 1 st medlem af gruppen |
| Vær < C N O | F | He | Fælles oxidationsnummer | +3 | +4 | +5 |
| -2 | -1 | 0 | Andre oxidationstilstande | +1 | +2, -4 | +3, -3 |
| +4, +2, | +3, +5, + 1, +7 | - | Egenskaber: | S-blokelementer: | Generelt er alle s-blokelementerne metaller. De er skinnende, gode elektriske og varmeledere og nemme at fjerne elektroner fra valensskal. De er de mest reaktive elementer i det periodiske bord. | P-blokelementer: |
De fleste af p-blokelementerne er ikke-metaller. De har lave kogepunkter, dårlige ledere og vanskelige at fjerne elektroner fra den yderste skal. I stedet får de elektroner. Nogle af de ikke-metaller er faste stoffer (C, P, S, Se) ved stuetemperatur, mens nogle er gasser (Oxygen, nitrogen). Brom er et ikke-metal, og det er en væske ved stuetemperatur.
Derudover indeholder p-blok nogle metalliske elementer; aluminium (Al), gallium (Ga), indium (In), tin (Sn), thallium (Tl), bly (Pb) og vismut (Bi). Image Courtesy:
1. "Periodisk tabel (polyatomisk)" af DePiep [CC BY-SA 3. 0] via Commons 2. "Periodiske tabelblokke spdf (32 kolonne)" af Bruger: DePiep [CC BY-SA 3. 0] via Commons



