Forskel Mellem EDTA og EGTA
EDTA vs EGTA
EDTA og EGTA begge er chelateringsmidler. Begge er polyaminocarboxylsyrer og har mere eller mindre de samme egenskaber.
EDTA
EDTA er det forkortede navn for ethylendiamintetraeddikesyre. Det er også kendt som (ethylendinitrilo) tetraeddikesyre. Følgende er strukturen af EDTA.
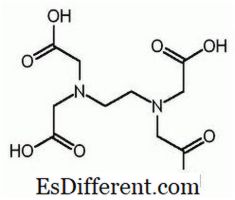
EDTA-molekylet har seks steder, hvor en metalion kan bindes. Der er to aminogrupper og fire carboxylgrupper. De to nitrogenatomer i aminogrupperne har et uafbrudt elektronpar i hver. EDTA er en hexadentatligand. Det er også et chelateringsmiddel på grund af evnen til at sekvestrere metalioner. EDTA danner chelater med alle kationer undtagen alkalimetaller, og disse chelater er tilstrækkeligt stabile. Stabiliteten stammer fra de flere kompleksdannelsessteder inden for molekylet, der giver anledning til en burlignende struktur, der omgiver metalionen. Dette isolerer metalionen fra opløsningsmiddelmolekyler og forhindrer således solvation. Carboxylgruppen af EDTA kan dissociere donerende protoner; derfor har EDTA sure egenskaber. De forskellige EDTA arter forkortes som H 4 Y, H 3 Y - , H 2 Y 2-, HY3 - og Y 4- . Ved meget lav pH (surt medium) er den protonerede form af EDTA (H 4 Y) overvejende. I modsætning hertil overgår højdeprotoneret form (Y 4- ) ved høj pH (basisk medium). Og da pH ændrer sig fra lav pH til høj pH, overgår andre former for EDTA i visse pH-værdier. EDTA er tilgængelig som fuldt protoneret form eller enten saltform. Dinatrium EDTA og calcium dinatrium EDTA er de mest almindelige saltformer tilgængelige. Den frie syre H 4 Y og dihydratet af natriumsaltet Na 2 H 2 Y. 2H 2 O er kommercielt tilgængelig i reagenskvalitet.
EGTA EGTA er det forkortede udtryk for ethylenglycoltetraeddikesyre. Det er et chelaterende middel og svarer meget til EDTA.EGTA har en højere affinitet for calciumioner end magnesiumioner. EGTA har følgende struktur.
I lighed med EDTA har EGTA også fire carboxylgrupper, der kan producere fire protoner ved dissociation. Der er to amingrupper, og de to nitrogenatomer i aminogrupperne har udelte elektronpar i hver. EGTA kan anvendes som en buffer til at ligne pH i en levende celle. Denne egenskab af EGTA tillader dets anvendelse i Tandem Affinity Purification, som er en proteinrensningsteknik.

Hvad er forskellen mellem



